| FAO Fisheries Synopsis No.100 | FRm/S100 SAST - Shrimp |
preparada por
ISABEL PEREZ-FARFANTE
U.S. Bureau of Commercial Fisheries
National Center for Systematics
Washington, D.C. 20560
y
Associate in Invertebrate Zoölogy, Museum of
Comparative Zoölogy, Harvard University,
Cambridge, Mass.
Penaeus schmitti Burkenroad, 1936, Anais Acad. bras. Cien. 8 (4): 315–318, Fig. 1–3.
No se conocen sinónimos objetivos. La especie había sido identificada con anterioridad erróneamente, con los nombres Cancer setiferus, Penaeus setiferus, Penaeus setifer y Palaemon setiferus, los cuales corresponden realmente a otra especie: Penaeus setiferus (L.) (= Cancer setiferus Linnaeus, 1767).
No existía consenso sobre el nombre científico que corresponde al camarón blanco del Caribe y el Atlántico de Sudamérica. Linneo (1767) en su descripción de Cancer setiferus senaló “Habitat Indiis” y lo identificó con el Astacus fluviatilis, Americanus Seba, 1759, camarón que no puede ser identificado por la descripción del autor ni por el dibujo que la ilustra. Aunque las localidades mencionadas son imprecisas, se deduce que el animal procede de las costas orientales de América y como el dibujo no presenta surcos adrostrales largos ni en las descripciones originales se hace referencia a ellos, se considera que C. setiferus es un camarón blanco o de surcos adrostrales cortos. El ejemplar tipo de Linneo no ha sido localizado (Burkenroad, 1939) por lo que parece que no podrá ser determinada objetivamente la especie a que realmente corresponde C. setiferus. Burkenroad (1936) descubrió que existían dos especies de camarones bajo esta designación; describió la especie del Caribe y el Atlántico de Sudamérica con el nombre de Penaeus schmitti y aplicó Penaeus setiferus a la del Atlántico de Norteamérica y el Golfo de México. Posteriormente (1939) dicho autor seleccionó un ejemplar del Estero de Matanzas, nordeste de la Florida, como neotipo (Yale Peabody Museum of Natural History, 4385) de Cancer setiferus L.
Gunter (1962a, 1962b) y Holthuis (1962) analizaron detalladamente los antecedentes dis ponibles sobre la procedencia del material que describieron Linneo y Seba, y llegaron a conclusiones discrepantes acerca de la validez de las denominaciones dadas por Burkenroad. Mientras que algunos carcinólogos impugnan dicho neotipo por improcedente, Holthuis (1964) sometió a la consideración de la Comisión Internacional de Nomenclatura Zoológica, una proposión para que, en uso de sus poderes, reconozca como neotipo el designado por Burkenroad.
La Comisión Internacional de Nomenclatura Zoológica en su Opinión 817 (Bull.Zool.Nomencl. 24, pt. 3 :151, 1967) en uso de sus Plenos Poderes, ha reconocido validez al ejemplar ♂ catalogado bajo B.O.C. 237, en la colección del Peabody Museum of Natural History, Yale University, como neotipo de Cancer setiferus Linnaeus. Dicha Comisión colocó en la Lista Oficial de Nombres Específicos de Zoología: setiferus Linnaeus, 1767 (nombre 2200), correspondiente al camarón neotipo, y schmitti Burkenroad, 1936 (nombre 2201).
Supragenérica
Phylum Arthropoda
Clase Crustacea
Subclase Malacostraca
Series Eumalacostraca
Superorden Eucarida
Orden Decapoda
Suborden Natantia
Sección Penaeidea
Familia Penaeidae
Subfamilia Penaeinae
Genérica
Género Penaeus Fabricius, 1798, Suppl. Entomol. Syst. :408
La especie Penaeus monodon Fabricius es la tipo de Penaeus por selección de Latreille (1810, Consid.gén.Anim.Crust.Arachn.Ins.:422). El neotipo de Penaeus monodon fué seleccionado por Holthuis, 1949:1056.
Penaeus Fabricius, 1798; De Man, 1911 :95–111; Burkenroad, 1934 :74; Kubo, 1949 :268–270; Dall, 1957 :141–142.
Rostro con dientes dorsales y ventrales. Caparazón sin suturas longitudinales ni transversales; con surcos cervical y órbito-antenal y carena antenal; con espinas antenal y hepática; y con margen pterigostomial redondeado. Telson con surco medial profundo, sin espinas subapicales fijas, con o sin espinas laterales movibles. Primer segmento antenular sin espina distroventralmedial. Flagelos antenulares más cortos que el caparazón. Palpos maxilares con dos o tres segmentos. Espinas en el basipodito del primer y segundo pereópodos; exópodos en los cuatro primeros pereópodos, generalmente también en el quinto. Petasma simétrico, en forma de vaina; lóbulos mediales de paredes delgadas, con o sin proyecciones distomediales; lóbulos laterales frecuentemente con costilla en el margen ventral. Apéndix masculino con el segmento distal subtriangular u ovoideo y armado de espinas. Télico generalmente con protuberancia anterior, de forma variable, entre los coxopoditos del cuarto par de pereópodos; con o sin placas laterales en el esternito XIV. Somitos IX-XIV con pleurobranquias; una artrobranquia rudimentaria en el VII y otra artrobranquia posterior en el XIII; mastigobranquias en los somitos VII-XII. Osículo zigocardíaco formado por un diente principal seguido de una hilera de dientes más pequeños, y, frecuentemente, con un grupo de dientes diminutos al final. Superficie del cuerpo lisa. (Según Dall, 1957, modificada).
Específica
Ejemplares tipos
Tipos: 1♂, 1♀, Yale Peabody Museum of Natural
History 4396 (BOC 128), colectados febrero
1, 1934.
Paratipos: 6♂, 7♀, 1 YPM 4850 (BOC 112), Bahía
de Kingston, Jamaica, febrero 1, 1934; 51♂,
46♀, YPM 4852 (BOC 113), Kingston, Jamaica,
febrero 1, 1934. 185♂, 165♀, YPM 4849 (BOC
111), Colón Panamá, febrero 11, 1934. 2♂, 3♀,
YPM 4851 (BOC 125), Río de Janeiro, Brasil, mayo
4, 1934.
Localidad típica
Bahía de Kingston, Jamaica.
Diagnosis
Surcos y carena adrostrales cortos, alcanzan sólo hasta el diente epigástrico. Sin carena gastrofrontal. Petasma con los lóbulos laterales sin costilla diagonal ni pliegue en la porción distal de la cara interna y con la esquina ventromedial extendida en forma de proyección subrectangular u orejuela pequeña. Escotadura en el lado medial de la solapa interna relativamente profunda. Cara externa de los lóbulos laterales armada con banda de espinas ancha en el extremo distal, donde se hallan hileras hasta de siete espinas, y progresivamente más estrecha hasta terminar en dos o una espina. Télico abierto; en el esternito XIV dos costillas anterolaterales subparalelas (sin desviarse hacia la línea medial del esternito) cada una seguida de una protuberancia redondeada y rígida.
Material examinado: Tipos y paratipos. También ochenta muestras de diferentes localidades del área de distribución de la especie (Pérez Farfante, 1969).
Clave para la identificación de los Penaeus del Atlántico occidental:
1. Surco adrostral corto, se extiende sólo hasta el diente epigástrico; sin carena gastrofrontal ............................................................................. 2
Surco adrostral largo, se extiende posteriormente mucho más allá del diente epigástrico; con carena gastrofrontal .......................................... 3
2. Petasma con la porción distal del lóbulo lateral con costilla diagonal en la cara interna y extremo ventromedial redondeado. Télico con dos costillas anterolaterales dobladas medialmente y dos lóbulos carnosos en la mitad posterior del esternito XIV........................ P. setiferus (L.)
Petasma con la porción distal del lóbulo lateral sin costilla diagonal en la cara interna y extremo ventromedial extendido en proyección subrectangular. Télico con dos costillas anterolaterales subparalelas, cada una seguida de una protuberancia rígida en el esternito XIV ................................................. P. schmitti Burkenroad.
3. Petasma con proyecciones distomediales largas, pliegue distolateral proyectado interiormente en orejuela grande; costilla ven tral con el ápice libre. Placas laterales del télico con la porción anteromedial extendida anteriormente dando lugar a dos prolongaciones adyacentes que cubren la protuberancia posterior ................................................. P. brasiliensis Lat.
Petasma con proyecciones distomediales relativamente cortas, pliegue distolateral sin formar orejuela, costilla ventral con ápice unido a la membrana adyacente. Placas laterales del télico con la porción anteromedial no extendida; protuberancia posterior con carena medial expuesta ................................................. 4
4. Petasma con la porción distal de la costilla ventral armada de espinas diminutas en el borde libre y ensanchándose abruptamente a la vez que dobla hacia el extremo proximal. Placas laterales con esquinas anteromediales ligeramente divergentes; protuberancia posterior con carena medial no bifurcada ................................................. 5
Petasma con la porción distal de la costilla ventral sin espinas en el borde libre, casi recta o en forma de arco y progresivamente más ancha hacia el extremo proximal. Placas laterales del télico con esquinas anteromediales ampliamente divergentes; protuberancia posterior con carena medial bifurcada anteriormente ................................................. 6
5. Surco dorsolateral estrecho, generalmente la relación quilla-surco mayor de 3 (medida en el tercio posterior del somito) y el surco con frecuencia casi cerrado ................................................. P. duorarum duorarum Burkenroad.
Surco dorsolateral ancho, generalmente la relación quilla-surco menor de 3 y hasta sólo 0,25.. P. duorarum notialis Pérez-Farfante.
6. Surcos adrostrales largos, terminan cerca del borde posterior del caparazón, profundos y anchos posteriormente, 0,75–2,00 el ancho de la carena postrostral ................................................. 7
Surcos adrostrales cortos, terminan distantes del borde posterior del caparazón, poco profundos y estrechos posteriormente, 0,20–0,75 el ancho de la carena postrostral. ................................................. P. aztecus subtilis Pérez-Farfante.
7. Surco medial largo y profundo en toda su extensión. Surco dorsolateral ancho, generalmente relación quilla-surco menor de 3 y hasta sólo 0,75. Petasma con la porción distal de la costilla ventral terminada en punta aguda y doblada en arco hacia el extremo proximal, con grupo alargado de dientes pequeños dispuestos en series contiguas en el borde de unión a la membrana adyacente. Télico con proceso apical y protuberancia posterior anchos ................................................. P. aztecus aztecus Ives.
Surco medial corto, poco profundo y generalmente interrumpido. Surco dorsolateral estrecho, generalmente relación quilla-surco mayor de 3 y surco a veces casi cerrado. Petasma con la porción distal de la costilla ventral terminada en punta roma, casi recta (no doblada en arco) y armada de dientes dispuestos irregularmente. Télico con el proceso apical y la protuberancia posterior estrechos ................................................. P. paulensis Pérez-Farfante.
P. schmitti es una morfoespecie con características típicas bien marcadas que la diferencian de la especie más próxima, P. setiferus. Estas dos especies son alopátricas, sin que haya indicios de superposición de las respectivas áreas de distribución.
Ninguna
Camarón blanco, Cuba, Centroamérica, Colombia, Venezuela; langostino blanco, Venezuela; camarão legítimo, camarão verdadeiro, camarão branco, Brasil; white shrimp, Estados Unidos de América; camarón casquiazul, Manzanillo, Cuba; blue shrimp, green shrimp, Estados Unidos de América.
General, incluyendo datos cuantitativos.
Rostro: fórmula dental  modo
modo  + epigástrico.
Rostro largo y delgado, recto, con
una concavidad en el margen posteroventral;
cresta rostral de forma variable, la parte
más alta coincide generalmente con el 2do.
diente, pero a veces con el 1ro. o el 3ro.;
punta del rostro estrecha y larga, hasta casi
igual a la mitad de la longitud del rostro.
Carena postrostral estrecha, larga en los juveniles
y más corta en los adultos, terminando
a 0,07–0,08 de la longitud del caparazón
(l.c.) del margen posterior del caparazón en
los primeros, y a 0,14-0,11 l.c. en los últimos.
Surco medio tenue, interrumpido. Carena
y surco adrostrales cortos, alcanzando sólo
hasta el nivel del diente epigástrico.
+ epigástrico.
Rostro largo y delgado, recto, con
una concavidad en el margen posteroventral;
cresta rostral de forma variable, la parte
más alta coincide generalmente con el 2do.
diente, pero a veces con el 1ro. o el 3ro.;
punta del rostro estrecha y larga, hasta casi
igual a la mitad de la longitud del rostro.
Carena postrostral estrecha, larga en los juveniles
y más corta en los adultos, terminando
a 0,07–0,08 de la longitud del caparazón
(l.c.) del margen posterior del caparazón en
los primeros, y a 0,14-0,11 l.c. en los últimos.
Surco medio tenue, interrumpido. Carena
y surco adrostrales cortos, alcanzando sólo
hasta el nivel del diente epigástrico.
Caparazón (Fig. 1A): sin carena ni surco gastrofrontales. Carena gastro-orbital pronunciada y afilada, ocupando los 0,60–0,75 posteriores de la distancia entre el margen postorbital del caparazón y la espina hepática. Surco cervical muy marcado en la mitad ventral y tenue dorsalmente, terminando a 0,40 l.c. del margen postorbital. Carena hepática afilada. Espina antenal aguda y relativamente corta; espina hepática prominente.
Flagelo antenular lateral largo, aproximadamente igual a 0,7 de la longitud del pedúnculo antenular; flagelo medial ligeramente más corto que el primero y con dimorfismo sexual acentuado: en el macho adulto aplanado lateralmente entre los extremos y armado en el borde dorsal de dos series contiguas de procesos dentiformes de distinto tamaño. Flagelo antenal muy largo, 2,5–2,75 la longitud total del cuerpo.
Abdomen: margen ventral de las pleuras del primer somito con escotadura honda, pero de profundidad variable hasta coincidir en su límite menor con la de los individuos de P. setiferus con escotadura más pronunciada. Sexto segmento con quilla afilada y delimitada por un surco dorsolateral estrecho y somero.
Petasma (Fig. 1C): porción distal interna del lóbulo lateral con la cara interna lisa, sin la costilla diagonal ni el pliegue presente en P. setiferus; esquina distroventral medial extendida en forma de proyección subrectangular u orejuela que llega hasta el margen ventral (Fig. 1D). Escotadura medial a la solapa interna relativamente profunda. Superficie externa del lóbulo lateral con banda ancha de espinas, de 5 a 7 en las hileras distales y progresivamente en menor número hasta terminar en una o dos espinas. A cada lado de la banda de espinas, en la porción distal, una cresta, la dorsal más prominente que la ventral, esta última bifurcada en un reborde. Lóbulo lateral frecuentemente más largo distalmente que el lóbulo medial.
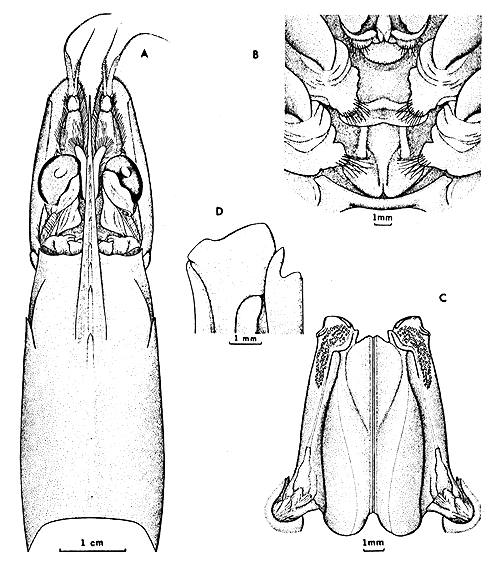
Fig. 1 Penaeus schmitti Burkenroad. A. cefalotórax, ♀ 42 mm l.c., Farol de Moela, Santos, Brasil. B. télico, ♀ 46 mm l.c., N. de Castilletes, Golfo de Venezuela, Venezuela. C. petasma, ♂ 32,75 mm l.c., frente a Tucuracas, Colombia. D. porción distal del petasma (cara interna), ♂ 36 mm l.c., Punta Araguapiche, Venezuela.
Apéndix masoulino: segmento distal sub-triangular y muy alargado, aproximadamente dos veces más largo que la anchura máxima, armado con espinas cortas en el borde medial y con espinas largas (casi igual a la mitad de la longitud del segmento) en la porción distal. Superficie antrorsa casi plana, excepto por una pequeña depresión en la base de la línea medial; superficie retrorsa profundamente cóncava y bordeada por una costilla prominente.
Télico (Fig. 1B): Tipo abierto; esternito XIV con dos costillas anterolaterales paralelas que se extienden hasta pasada la mitad del esternito (sin desviarse hacia la línea medial) cada una seguida de una protuberancia redondeada o subcónica con ápices inconspicuos. Placa medial del esternito XIII con costilla transversal prominente cerca del borde posterior y extendida sobre el esternito XIV. Margen posterior del esternito XII provisto de dos proyecciones a cada lado, las laterales con frecuencia más prominentes.
Tamaño: El ejemplar de mayor tamaño mencionado en la literatura fue una hembra de 235 mm longitud total (l.t.), citada por Davant (1963). El macho de mayor tamaño medía 43,0 mm de caparazón (aproximadamente 175 mm l.t.), citado por Ewald (1965).
Color: Blanco translúcido, generalmente azulado por el predominio de cromatóforos azules, pero a veces grisáceo, verdoso o amarillento, y de aspecto vidrioso. Pequeñas manchas de cromatóforos salpican el cuerpo. Una banda estrecha azul oscuro corre paralela al borde posterior del caparazón y de los somitos abdominales; los urópodos y la cola están bordeados de una franja azul oscuro; una coloración rojiza cubre frecuentemente el dactilopodito de los pereópodos y los pleópodos.
Variaciones geográficas
Los estudios biomótrioos realizados (Pĕrez-Farfanto, 1969) en los cualas se tomaron en consideración 40 caracteres morfológioos, indican que P. schmitti muestra variaciones que oscilan dentro de los mismos límites, aproximadamente, en diferentes áreas. No se han observado características peculiares a poblaciones en particular.
Descripción de cambios morfológioos durante el crecimiento, incluyendo datos cuantitativos
En P. schmitti, durante la etapa juvenil, el rostro orece en proporción al caparazón progresivamente hasta un máximo de 0,90–0,96 en el camarón de 13–16 mm l.o. (Fig. 2) y avanza anteriormente hasta 0,75 de la porción basal, más ancha, del flagelo lateral. A partir de dichas longitudes del caparazón, la proporción 1.r./1.c. desciende a medida que el camarón crece, hasta un mínimo de aproximadamente 0,53–0,55, en el camarón de 45–47 mm de caparazón. El crecimiento del caparazón en relación al crecimiento en longitud total es más lento en los juveniles; cuando el camarón alcanza aproximadamente 100–108 mm l.t. el crecimiento del caparazón aumenta en relación al crecimiento en longitud total. La medida longitud del caparazón corresponde a la distancia del margen postorbital al punta medial del margen posterior del caparazón, y la longitud total, a la distancia de la punta del rostro al extremo posterior del telson. García-Pinto (1965) encontró dos discontinuidades en la relación entre los promedios de la l.c. y l.t., así como entre los del diámetro del caparazón y los de la longitud total. No se sabe si los cambios descritos son de origen fisiclógico o debido a cambios ecológicos.
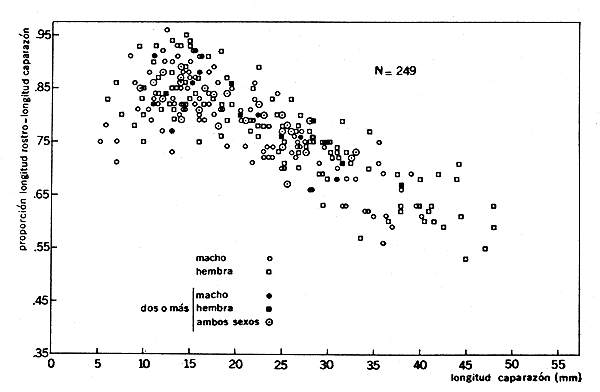
Fig. 2 Penaeus schmitti Burkenroad. Variaciones en la proporción longitud rostrolongitud caparazón con el crecimiento.
P. schmitti se extiende a lo largo de las Antillas Mayores, Islas Vírgenes, probablemente llega a las Antillas Menores, y se encuentra en Trinidad. En la plataforma continental se extiende desde Belice, Honduras Británica, a lo largo de las costas del Caribe y la costa atlántica de Sudamérica hasta Laguna, Brasil, donde la especie fue identificada por Lindner (1957) y reportada por Richardson y Moraes (1960). Su distribución, por tanto, está comprendida entre las latitudes 23° 15'N y 28° 29'S (Fig. 3). Aunque Burkenroad (1939) citó P. setiferus de Cuba, Pérez-Farfante (1953) señaló que no lo había encontrado en aguas de la isla. Posteriormente (Pérez-Farfante 1954; Pérez-Farfante et al., 1961) tampoco lo halló en el material estudiado ni en otras colecciones revisadas, por tanto, considera que P. schmitti es, probablemente, el único camarón blanco que vive en aguas cubanas. Según Bate (1881) la descripción de P. setiferus de H. Milne Edwards (1837) se basó en un ejemplar de la isla de Guadalupe; ésta es la única cita del camarón blanco (casi seguramente P. schmitti) en las Antillas Menores.
Esta especie, como P. setiferus en aguas del norte, tiene una distribución discontinua; no sólo está ausente en extensas áreas de su distribución general, sino que en áreas reducidas se hallan poblaciones aisladas unas de otras. En el muestreo intensivo llevado a cabo en aguas de Cuba, la autora encontró que mientras P. duorarum notialis vive en numerosas localidades alrededor de la isla, P. schmitti, en la costa sur, se extiende sólo por la mitad oriental. Eldred y Hutton (1960) reportaron P. schmitti, de las proximidades de Cabo Kennedy, Florida, en base de la información obtenida de H.R. Bullis; sin embargo, Pérez-Farfante (1969) no ha hallado esta especie en las colecciones que ha examinado de esa área.
No se dispone de información sobre hallazgo de huevos en áreas de desove.
Las larvas viven en el mar y a medida que crecen y tiene lugar su metaforfosis, se trasladan hacia aguas estuarinas ricas en materias nutritivas; los estados larvales son más avanzados cuanto más cerca de la costa se encuentran.
Ewald (1965) identificó postlarvas hasta de 10 mm l.t. en número de miles en el Estrecho de Maracaibo. indicación de una inmigración desde la Ensenada de Calabozo, en el Golfo de Venezuela, donde se concentran las hembras maduras, hacia el Lago de Maracaibo. Las postlarvas avanzadas y los juveniles se desarrollan en aguas de baja o moderada salinidad. En la Bahía de Tablazo y en las costas occidental y noreste del Lago de Maracaibo se han encontrado individuos con un largo total entre 15 y 30 mm. En aguas estuarinas de la costa sur de Camagüey, Cuba, Pérez-Farfante et al. (1961) colectaron numerosos juveniles de 20–50 mm 1.t. de marzo a julio, muy pocos en septiembre y ninguno en agosto y entre octubre y diciembre.
Los adultos de P. schmitti viven en aguas marinas de poca profundidad que, de acuerdo con los datos disponibles, alcanza solamente hasta 27 m aproximadamente. Tiene, por tanto, una distribución batimétrica más limitada que las especies acanaladas simpátricas P. d. notialis, P. aztecus subtilis, P. brasiliensis y, en el extremo sur de su área de distribución longitudinal, P. paulensis, las cuales alcanzan mayores profundidades; P. brasiliensis hasta 273 m, profundidad a la que fue colectada por el Oregon en la estación 2471, al oeste de la isla de Andros, Bahamas. La distribución batimétrica de P. schmitti, aunque más restringida, corresponde a la de P. setiferus en aguas del norte. Dentro del límite de profundidad señalado, P. schmitti se encuentra en el Golfo de Venezuela (Ewald, 1965), en aguas de la porción sudeste de la plataforma de Cuba, fue hallada por el Oregon en las costas del Caribe y del Atlántico al norte de Sudamérica y por el Emilia (Tremel et al., 1964) en las costas de Brasil. Los ejemplares de mayor profundidad que la autora ha examinado proceden, precisamente, de 27 m, colectados por el Oregon en la estación 2210, frente a la Punta Araguapiche, Venezuela. Estos animales ocupan fondos de fango, frecuentemente mezclados con arena (de origen coralino en muchas localidades) y fragmentos pequeños de conchas de moluscos; aunque en escaso número, también se hallan en bolsillos predominantemente arenosos en fondos rocosos. En algunas localidades como la Bahía de Santa Clara y la costa sur de Camagüey, Cuba, vive en fondos relativamente firmes, mientras que en otras, como el Golfo de Guacanayabo, habita en fondos blandos.
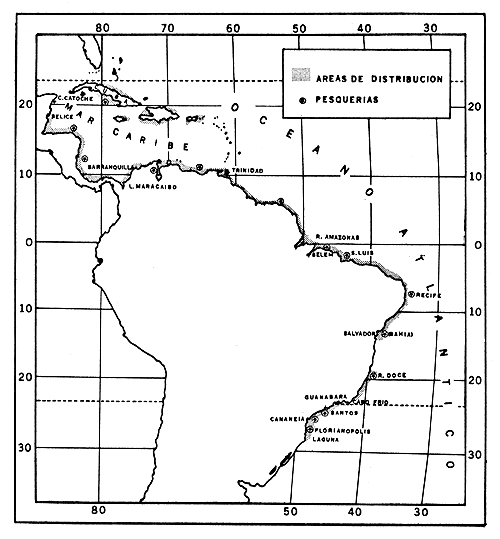
Fig. 3 Penaeus schmitti Burkenroad. Mapa con la distribución geográfica y las áreas de pesca.
P. schmitti es heterosexual.
Dimorfismo sexual: El camarón blanco, como sus congéneres, muestra un diformismo sexual acentuado. El petasma y el apéndix masculino en uno, y el télico y endopodito rudimentario del primer par de pleópodos en el otro, diferencian marcadamente los dos sexos. Además, P. schmitti, como P. setiferus, muestra dimorfismo sexual en el flagelo antenular medial o ventral, como se señaló anteriormente (véase sección 1.31)
Esta especie muestra una diferencia de tamaño entre los sexos como lo indica la máxima longitud que alcanza cada uno (véase sección 1.31 y Fig. 3). La diferencia es evidente en el Golfo de Venezuela donde Ewald (1965) encontró que el promedio de tamaño de las hembras (33,12 mm 1.c.) es superior al de los machos (30,2 mm 1.c.). En la población más joven del Lago de Maracaibo los promedios de tamaños son muy próximos (23,8 mm 1.c. el de las hembras y 23,3 mm 1.c. el de los machos) pero el tamaño máximo que alcanzan las hembras es mayor en cada una de las áreas, lo que parece indicar que la diferencia se inicia antes de emigrar hacia aguas marinas.
Entre un mínimo de 21 mm 1.c. y un máximo de 27 mm 1.c., tiene lugar la unión del petasma y por tanto dentro de estos límites los machos pueden ser considerados aptos para la cópula. Las hembras de 21 mm 1.c. muestran el télico aparentemente desarrollado, sin embargo, solamente ejemplares mayores de 21 mm 1.c., han sido encontrados portando espermatóforos. El número de hembras impregnadas que han sido halladas es tan pequeño, que no se ha podido establecer el tamano mínimo a que éstas pueden copular. Tampoco se cuenta con datos sobre el tamaño mínimo a que los ovarios alcanzan el estado de madurez.
No ha sido observada. Se le supone promiscuo. En P. schmitti, como en otras especies con télico abierto, la cópula parece que tiene lugar entre individuos con el exoesqueleto endurecido, de distinta manera de lo que ocurre en las especies de télico cerrado. El espermatóforo es una estructura en forma de vaina compuesta en realidad por dos unidades que se encuentran en las vesículas terminales del macho y se unen en el momento de su expulsión. Está dotado a cada lado de la parte anterior de un proceso aliforme armado de una pequeña proyección triangular en el borde posterior. Lleva además dos placas laterales en su porción posterior. Por medio de estas estructuras el espermatóforo se fija al télico, ayudado por una sustancia gelatinosa que lo acompaña cuando es expulsado, así como por sedas que se proyectan de la extensión coxal aplanada del cuarto y quinto par de pereópodos. Ewald (1965) encontró hembras impregnadas en el Golfo de Venezuela de abril a septiembre, y la autora, en Cuba, de febrero a mayo.
No se ha observado. Se supone externa, que al salir por el gonoporo, en el tercer par de pereópodos, los óvulos son fertilizados por los espermatozoides contenidos en el espermatóforo.
Se reconocen, por caracteres externos, cuatro etapas en el desarrollo de los ovarios, que son similares a las descritas por King (1948) en P. setiferus: 1. sin desarrollar, ovarios muy delgados y translúcidos; 2. en desarrollo, ovarios opacos con cromatóforos en la superficie; 3. casi maduros o etapa amarillo-naranja, y 4. ovarios muy agrandados, de color aceitunado, a veces pardusco.
Se calcula que la hembra produce en una puesta de medio a un millón de huevos.
Se dispone de muy poca información. Aparentemente tiene lugar en aguas marinas de poca profundidad. Ewald (1965) dio cuenta de que en el Golfo de Venezuela sólo encontró hembras maduras en la Ensenada de Calabozo, a profundidades entre 19 y 27 m aproximadamente, y aguas de una salinidad que oscila entre 15 y 25‰. La autora colectó en la costa sur de Camagüey, Cuba, hembras a punto de desovar, en aguas de 14 a 20 m (la última profundidad, límite del muestreo) y salinidades entre 35 y 36‰. No se dispone de información acerca del número de veces que una hembra puede desovar. El hecho de que se hayan encontrado hembras maduras de tamaños muy distantes, entre 30 y 50 mm 1.c., hace suponer que tiene lugar más de una vez a lo largo de la vida.
Epocas de desove
Sólo se cuenta con datos fragmentarios. En la costa sur de Camagüey y en el Golfo de Guacanayabo, Cuba, se colectaron hembras maduras de marzo a junio. La presencia de individuos muy pequeños, 20 mm 1.t., en las aguas estuarinas de esas áreas en marzo, indica que el desove también debe tener lugar en febrero. En el Golfo de Venezuela el período de máximo desove corresponde al segundo trimestre del año (Ewald, 1965). Da Silva (1965) en la Bahía de Sepetiba, Brasil, colectó larvas avanzadas en marzo y abril junto con juveniles, lo que sugiere que en esa región el desove se prolonga hasta fines del verano.
No se ha publicado estudio alguno sobre el ciclo larval de esta especie. Sin embargo, como P. setiferus experimenta una metamorfosis similar a la de los Penaeus simpátricos acanalados, es de suponer que P. schmitti, más estrechamente emparentado con el primero, pase por las mismas subetapas larvales, o sea, cinco nauplia, tres protozoea y tres mysis (Dobkin, 1961; Cook, com.per.). El último mysis se transforma en la primera de una serie de postlarvas que se caracterizan por tener el sexto somito abdominal considerablemente más largo que los restantes y el rostro más corto en proporción a la longitud del caparazón que los juveniles. A medida que el rostro crece, el número de dientes aumenta.
Los juveniles tienen la morfología general del adulto y poseen la dentición rostral definitiva. Cuando alcanzan 20 mm de longitud pueden distinguirse fácilmente de los de las especies acanaladas porque carecen de surcos adrostrales que en los últimos, a ese tamaño, están bien definidos. Su sexo puede ser determinado por la posición y tamaño del endopodito del primer par de pleópodos, que en el macho es mayor y está situado más separado del extremo distal. Además, a los 22 mm de longitud el apéndix masculino, aunque pequeño, está claramente desarrollado.
Los juveniles permanecen en aguas estuarinas ricas en materias nutritivas donde crecen rápidamente.
Se estima que P. schmitti tiene un promedio de vida de año y medio. El gran tamaño que alcanzan algunos individuos parece indicar que la vida de este camarón puede prolongarse hasta, por lo menos, dos años.
Los peces son sin duda uno de los principales enemigos de éste como de otros Penaeus. Pérez-Farfante (1969) ha hallado camarones blancos en el estómago de distintas especies de la familia Lutjanidae. También son víctimas de sus semejantes; el canibalismo es una de las causas por las que se dificulta mantenerlos en acuarios.
P. schmitti es atacado por una enfermedad conocida por la mancha negra, de incidencia más alta en unas áreas que en otras, producida por un protozoo microsporidio.
En el estómago de esta especie se ha encontrado, además de detritos orgánicos e inorgánicos, algas y una gran variedad de animales, entre éstos, diferentes especies de nematodos, anélidos, moluscos y crustáceos.
La información sobre el crecimiento de P. schmitti es muy limitada. Hay una declaración anónima (1962) de que en Guyana individuos de unos 25 mm l.t. crecieron en estanques de agua salobre hasta alcanzar 200–225 mm l.t. en un período de siete a ocho meses. Ewald (1965) calculó que en el Lago de Maracaibo, donde viven juveniles y adultos jóvenes, crece hasta 50 mm al mes.
El camarón blanco describe dos trayectorias opuestas para completar su ciclo vital; las larvas se originan en el mar y se trasladan hacia aguas estuarinas donde llegan en forma de postlarvas, las que pronto se tornan en juveniles que crecen rápidamente en esas aguas ricas en materias nutritivas. Ocupan fondos blandos de sedimentos, con abundan te vegetación, en muchas áreas, zonas de manglares. A medida que los camarones crecen abandonan las aguas interiores y repasan el camino para llegar a las áreas de desove. Ewald (1965) obtuvo una clara indicación de esta migración hacia aguas marinas: mientras que en el Lago de Maracaibo las mayores hembras examinadas medían 36 mm l.c., en el Golfo de Venezuela predominaban los individuos de mayor talla y eran comunes los de 54 mm l.c. La autora encontró frente a Santa Cruz del Sur, Cuba, individuos pequeños cerca de la costa, y progresivamente mayores, a medida que aumentaba la profundidad y distancia del litoral, gradiente indicativo de la emigración hacia las zonas donde aparentemente se reproducen. Se ha observado que el camarón se desplaza localmente en busca de alimento, protección, y por efecto de estímulos externos, como cambios de temperatura, iluminación o movimientos de las aguas.
P. schmitti es altamente gregario. Los juveniles y subadultos se concentran en las aguas estuarinas y lagunas costeras. La emigración hacia el mar se realiza por grupos tan numerosos que en algunas localidades constituyen la fuente de máxima productividad. Los adultos forman y se mueven en cardúmenes.
En las aguas estuarinas, particularmente en ciertos períodos del ano, se mezclan postlarvas, juveniles y adultos jóvenes.
El camarón blanco en el Caribe se encuentra asociado principalmente con el camarón acaramelado, P. duorarum notialis y P. a. subtilis.
La asociación con la última especie es más frecuente en las costas de Sudamérica (Lindner, 1957; Holthuis, 1959; Ewald, 1965). En las aguas interiores del continente a veces se halla con P. brasiliensis, esta asociación, sin embargo, parece más frecuente al sur de cabo Frío (Tremel y Mistakidis, 1965) donde también se encuentra con P. paulensis. Los adultos de las especies acanaladas, excepto P. d. notialis, se trasladan hacia aguas más profundas y lejanas de la costa que las que ocupa P. schmitti.
Estímulos ambientales
Químicos
El camarón blanco parece tener la más alta preferencia por aguas de baja salinidad, entre las especies simpátricas de Penaeus. De acuerdo con da Silva (1965) el camarao legítimo predomina, hasta el punto de que es prácticamente la única especie comercial, en la Bahía de Sepetiba, de muy baja salinidad por el aporte de las aguas de unos doce ríos. Los juveniles se encuentran en un porcentaje mucho más elevado que los de las otras especies en el Lago de Maracaibo, donde se han hallado en aguas de una salinidad menor de 1‰. Dentro del Golfo de Venezuela los adultos se concentran en la Ensenada de Calabozo, el área de más baja salinidad (Ewald, 1965). Los juveniles, sin embargo, muestran una relativamente amplia tolerancia a variaciones de salinidad, como indican los trabajos de Davant (1963), quien colectó ejemplares en la Laguna Unare, Venezuela, en salinidades de 18 a 32‰. Según Sadowski y Radasewski (1960), en las lagunas costeras de las proximidades de Cananéia viven en aguas de 20 a 25‰. Aparentemente, los juveniles no toleran salinidades extremas puesto que según Ewald (1965), no se hallan en el Golfete de Coro, al este del Golfo de Venezuela, de aguas altamente salinas debido a una intensa evaporación. El complejo Lago de Maracaibo-Estrecho de Venezuela contiene la población de camarón blanco de más alta densidad; la gran extensión de aguas estuarinas se considera el factor principal de su éxito en esa región.
Térmicos
No se han realizado investigaciones sistemáticas sobre la tolerancia y reacciones a las variaciones de la temperatura de P. schmitti. Su distribución geográfica, sin embargo, indica una adaptación a variadas condiciones térmicas. Abunda en las aguas del Caribe, donde en invierno las temperaturas superficiales descienden a unos 22°C y en verano suben, por lo menos, a 33°C (Suárez Caabro, 1959; Fuglister, 1960; Cruz, 1966), y también en las aguas más frías del sur del Brasil que reciben influencia de una rama costera de la Corriente de Falkland.
Opticos
En muchas áreas la pesca comercial de P. schmitti se realiza indistintamente de día y de noche y no se han señalado marcadas diferencias en el volumen de las capturas, lo que sugiere que los cambios de iluminación no afectan mayormente sus hábitos de reposo o actividad; este comportamiento es diferente al de las especies acanaladas, que son fundamentalmente nocturnas. En Cananéia, sin embargo, las capturas se llevan a cabo en las primeras horas de la mañana (Boschi, 1963).
Los artes de pesca que se emplean para la captura del camarón blanco consisten en: i) redes de arrastre grandes, de tipo americano (shrimp otter trawl) o de tipo italiano (utilizadas en el Golfo de Venezuela para la captura de peces y camarones); redes de arrastre medianas y pequeñas. ii) diversos tipos de redes para ser operadas cerca de la costa, en aguas bajas, por dos o más pescadores, y a veces con el auxilio de embarcaciones medianas o pequeñas, y que comprenden la mandinga y el copito, de las costas venezolanas (Pericchi López, 1965). Los chinchorros o picares, las redes de espera y las puças o salabres, utilizados en las lagunas costeras, bahías, estuarios, y en aguas someras de las costas del Estado de Santa Catarina (Mistakidis en FAO/UN, 1964). iii) por último, la atarraya, de uso muy extendido en las pesquerías de camarón blanco, muchas en aguas interiores. Las atarrayas que se emplean son de varias dimensiones, distintos calibres de hilo y diferentes tamaños de malla.
Las mayores embarcaciones empleadas en la pesca del camarón en el Caribe y Atlántico de Sudamérica, son los arrastreros de diseño y construcción norteamericana en su mayoría. Su introducción tuvo lugar a principios de la década del cincuenta y trajo consigo un aumento espectacular de la producción. El tamaño de estos barcos varía entre 12 y 25 m de eslora, están impulsados por motores diesel y equipados con montacargas, ecosonda, radio y redes de arrastre. Es difícil determinar con precisión el número de los que operan en cada zona pesquera porque no todos aparecen anotados en los registros oficiales. Actualmente su empleo está muy generalizado en Honduras, Nicaragua, Cuba, Venezuela y algunos centros pesqueros del Brasil.
En la pesca artesanal se emplean distintos tipos de embarcaciones menores, impulsadas a remo o por motores pequeños (Pericchi López, 1965; da Silva, 1965; Tremel y Mistakidis, 1965).
La distribución geográfica general de las pesquerías de P. schmitti se muestra en la Fig. 4, en forma aproximada, ya que no se han hecho levantamientos de la extensión de las mismas.
P. schmitti forma parte de las capturas comerciales en el sudeste de la plataforma cubana; en las costas del Caribe de Honduras (Loesch, 1962) y Nicaragua; en las lagunas costeras cerca de la desembocadura del Río Magdalena, al norte de Colombia (Lindner, 1957); en el complejo Golfo de Venezuela-Lago Maracaibo, en las lagunas Unare y Píritu y otras localidades de las costas venezolanas (Davant, 1963); y en las Guayanas (Lindner, 1957; Holthuis, 1959). Por último, en Brasil, en los estuarios al este del Río Amazonas; en San Luis (Lindner, 1957), Parnaiba, Recife y en la Bahía de Salvador (Pérez-Farfante, 1969); desde Río Doce a Cabo Frío (Lindner, 1957); Bahía de Guanabara y Bahía de Sepetiba (da Silva, 1965); en las costas de los Estados de San Pablo (Sadowski y Radasewski, 1960; Braga, 1962), Paraná y Santa Catarina (Richardson y Moraes, 1960; Tremel et al., 1964; Tremel y Mistakidis, 1965).
El camarón blanco se pesca en lagos y lagunas costeras, estuarios, bahías y en una banda estrecha de aguas litorales someras.
La pesquería del Lago de Maracaibo-Golfo de Venezuela es la de mayor rendimiento en tode el área de distribución de P. schmitti. Según Ewald (1965) el camarón blanco es la especie predominante en la cosecha comercial en el Lago Maracaibo y la Ensenada de Calabozo, donde el monto de su pesca llega al 100 por ciento de la captura. En la bahía de Tablazo la producción de P. schmitti constituye más del 90 por ciento de las capturas y en la porción sur del Golfo de Venezuela el 50 por ciento.
La mayoría de las pesquerías del camarón blanco están localizadas en áreas que reciben grandes aportes de agua dulce. El Lago de Maracaibo y la Bahía de Tablazo parecen reunir las condiciones ecológicas óptimas para el desarrollo de P. schmitti. Ocupan la porción inferior de una hoya geográfica colectora de abundantes precipitaciones. El aporte de agua salada proveniente del Golfo de Venezuela da lugar a una mezcla de aguas dulces y marinas con una clorinidad que fluctúa estacionalmente entre 0,1 y 12 partes por mil. Según da Silva (1965), la única especie de valor comercial en la Bahía de Sepetiba, donde desaguan una docena de ríos y canales, es el camarón blanco. La porción sudeste de la plataforma insular de Cuba, donde se pesca esta especie, es una zona de drenaje donde desembocan varios de los ríos más importantes de la isla.
P. schmitti es capturado en aguas estuarinas y costeras de poca profundidad. Las áreas de mayor productividad del Lago Maracaibo están dentro de los 20 m aproximadamente, mientras que las de la Ensenada de Calabozo alcanzan hasta 27 m. Las pesquerías cubanas sobre la plataforma sur de la isla no exceden de los 20 m de profundidad. La Bahía de Sepetiba, donde P. schmitti constituye el único camarón de explotación comercial del área, presenta profundidades de entre 2 y 20 m (da Silva, 1965). Tremel et al. (1964), en investigaciones realizadas en las costas del Estado de Santa Catarina encontraron que el camarón blanco abundaba en las zonas central y norte, cerca de la costa y a profundidades entre 15 y 20 m.
No existen datos concretos
En algunas localidades la pesca del camarón blanco se realiza sin interrupción a lo largo del año. Así ocurre, según Ewald (1965) en el Lago de Maracaibo, la Ensenada de Calabozo y porción sur del Golfo de Venezuela, aunque la temporada de mayor abundancia es de marzo a junio.
Tremel y Mistakidis (1965) concluyeron que en Armação da Piedade, Brasil, la pesca de camarão legítimo parecer ser continua. En otras localidades es estacional, como en las restantes áreas de pesca del Golfo de Venezuela y la laguna Unare, donde, de acuerdo con Davant (1963) tiene lugar de septiembre a mayo. Según Loesch (1962), en Honduras abunda en las capturas desde agosto hasta la mitad de noviembre. Braga (1962) compiló los desembarcos en Santos de julio a diciembre y los del año 1959. En el primer período la producción máxima, de 4.600 kg correspondió a octubre y comprendió, aproximadamente, el 50 por ciento de los desembarcos durante dichos meses. En 1959 las mayores capturas correspondieron al período abril-julio, con un promedio mensual de unos 11.800 kg, mientras que en los restantes meses la máxima captura no alcanzó la mitad de esta cifra.
La información disponible es muy limitada; salvo en muy pocas áreas, no existen estadísticas de la producción que permitan determinar el volumen anual del total de las capturas. Ewald (1965) reportó que en 1964 la producción camaronera del Lago de Maracaibo-Golfo de Venezuela, ascendió a 4.249 kg, y de esta cifra la más alta proporción estaba constituida por P. schmitti. Según los datos recopilados por Neiva y Wise (1964) la producción desembarcada en Santos promedió, aproximadamente, 85.400 kg al año durante el período 1959–1963.
Los datos estadísticos presentados por Tremel y Mistakidis (1965), señalan que en el Estado de Santa Catarina se capturó en el período 1961–1963 un promedio anual de 21.000 kg.
Muchas de las regulaciones establecidas en los países donde existen pesquerías son de base empírica. Algunas medidas adoptadas para la conservación del camarón como recurso de valor económico limitan las áreas de captura, el período de explotación, el tipo de arte empleado y el volumen de pesca. Sin embargo, en la mayoría de los casos estas regulaciones responden a intereses locales. Está muy generalizado el criterio de que las redes de arrastre producen efectos dañinos a los fondos, así como al resto de las especies comerciales, y en algunas áreas se restringe su utilización.
Bate, C.S., 1881 On the Penaeidae. Ann.Mag.nat.Hist. 8(5):169–96
Boschi, E.E., 1963 Los camarones comerciales de la familia Penaeidae de la costa atlántica de América del Sur. Clave para el reconocimiento de las especies y datos bioecológicos. Boln Inst.Biol.mar., Mar d.Plata, (3):39
Braga. A.S., 1962 Métodos de compilação e computação de dados estadísticos de desembarque de pescado no pôrto de Santos. Bolm Inst.Oceanogr., S Paulo, 12(2):39–61
Burkenroad, M.D., 1934 The Penaeidea of Louisiana with a discussion of their world relationships. Bull.Am.Mus.nat.Hist., 68(2):61–143
Burkenroad, M.D., 1936 A new species of Penaeus from the American Atlantic. Anais Acad.bras.Cienc., 8(4):315–8
Burkenroad, M.D., 1939 Further observations on Penaeidae of the northern Gulf of Mexico. Bull.Bingham oceanogr.Coll., 6(6):1–62
Dall. W., 1957 A revision of the Australian species of Penaeinae (Crustacea Decapoda: Penaeidae). Aust.J.mar.Freshwat.Res., 8(2):136–231
da Silva, O., 1965 Alguns dos peneídeos e palinurídeos do Atlántico Sul. Rio de Janeiro, Superintendencia do Desenvolvimento da Pesca, Estado da Guanabara, Ministério da Agricultura, 20 p.
Davant, P., 1963 Clave para la identificación de los camarones marinos y de río con importancia económica en el oriente de Venezuela. Cuad.oceanogr.Univ.Oriente, (1):1–57; en inglés, (1):59–113
de la Cruz, S.A., 1966 Estudios de plancton en la plataforma sur de Cuba. Contrnes Cent.Invest. pesq.Habano, (22):54 p.
de Man, J.G., 1911 The Decapoda of the Siboga-Expedition, 1. Family Penaeidae. Siboga Exped., 39a:131 p.
Dobkin, S., 1961 Early developmental stages of pink shrimp, Penaeus duorarum from Florida waters. Fishery Bull.Fish Wildl.Serv.U.S., 61(190):321–49
Eldred, B. and R.F. Hutton, 1960 On the grading and identification of domestic and commercial shrimps (Family Penaeidae) with a tentative world list of commercial penaeids. Q.Jl Fla Acad.Sci., 23(2):89–118
Ewald, J.J., 1965 Investigaciones sobre la biología del camarón comercial en el occidente de Venezuela. Infme a.Fondo nac.Investnes agropec., Caracas, 2:1–114, 139–47
Ewald, J.J., 1965 The shrimp fishery in western Venezuela. Proc.Gulf Caribb.Fish.Inst., 17:23–30
Fabricius, J.C., 1798 Supplementum entomologiae systematicae. Copenhagen, Denmark, Hafnaiae, 572 p.
FAO/UN, 1964 Informe a los gobiernos de Brasil, Uruguay y Argentina sobre investigación y determinación de los recursos camaroneros. Basado en el trabajo de Michael N. Mistakidis. Rep.FAO/EPTA (1964):48 p.
Fuglister, F.C., 1960 Atlantic ocean atlas of temperature and salinity profiles and data from the International Geophysical Year of 1957–1958. Contr.Woods Hole oceangr.Inst., (1108):209 p.
García Pinto, L.J., 1965 Estudio morfométrico del camarón blanco Penaeus schmitti Burkenroad, 1936. En Investigaciones sobre la biología del camarón comercial en el occidente de Venezuela por J.J. Ewald. Infme a.Fondo nac.Investnes agropec., Caracas, 2:131–6
Gunter, G., 1962a Specific names of the Atlantic American white shrimp (family Penaeidae). Gulf Res.Rep., 1(3):107–14
Gunter, G., 1962b Reply to Dr. L.B. Holthuis on the names of white shrimp. Gulf Res.Rep., 1(3):118–21
Gunter, G., 1963 The proper zoological name of the North American white shrimp. Proc.Gulf Caribb. Fish.Inst., 15:103–110
Gunter, G., 1964 Objections to the proposed validation under plenary powers of a neotype for Cancer setiferus L. 1767 (Crustacea Decapoda). Bull.zool.Nom., 21(3):229–32
Holthuis, L.B., 1949 The identity of Penaeus monodon Fabr. Proc.K.ned.Akad.Wet., 52(9):1051–7
Holthuis, L.B., 1959 The Crustacea Decapoda of Suriname (Dutch Guiana). Zool.Verh.Leiden, 44:296 p.
Holthuis, L.B., 1962 On the names of Penaeus setiferus (L.) and Penaeus schmitti Burkenroad. Gulf Res.Rep., 1(3):115–8
Holthuis, L.B., 1964 Cancer setiferus Linnaeus, 1767 (Crustacea Decapoda): proposed validation of neotype selection under the plenary powers Z.N. (S.) 1617. Bull.zool.Nom., 21(3):227–9
King, J.E., 1948 A study of the reproductive organs of the common marine shrimp, Penaeus setiferus (Linnaeus). Biol.Bull.mar.biol.Lab., Woods Hole, 94(3):244–62
Kubo, I., 1949 Studies on the penaeids of Japanese and its adjacent waters. J.Tokyo Coll.Fish., 36(1):1–467
Lindner, M.J., 1957 Survey of shrimp fisheries of Central and South America. Spec.scient.Rep.U.S.Fish Wildl.Serv.Fish., (235):166 p.
Linné, C., 1767 Systema Naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis, ed. 12, 1(2):533–1327
Loesch, H., 1962 The developing shrimp fishery of Honduras. Proc.Gulf Caribb.Fish.Inst., 14:171–8
Martens, E. von, 1872 Ueber cubanische crustaceen nach dem sammlungen Dr. Gundlach's. Arch.Naturgesch., 38(1):77–147
Milne Edwards, H., 1837 Histoire naturelle des crustacés, comprenant l'anatomie, la physiologie et la classification de ces animaux. Paris, vol. 2:532 p.
Neiva G. de S. and J.P. Wise, 1964 The biology and fishery of the sea bob shrimp of Santos Bay, Brazil. Proc.Gulf Caribb.Fish.Inst., 16:131–9
Olivier, G.A., 1811 Encyclopédie méthodique. Historie Naturelle. Insectes, 8:722 p.
Pérez-Farfante, I., 1953 Los camarones comerciales de Cuba. Mems Soc.cub.Hist.nat.‘Felipe Poey’, 21(2):229–43, also issued as Contrnes Cent.Invest.pesq.Habano, (1):16 p.
Pérez-Farfante, I., 1954 Los camarones comerciales de Cuba, Pt. 2, Contrnes Cent.Invest.pesq.Habano, (6):31 p.
Pérez-Farfante, I., 1967 A new species and two new subspecies of shrimp of the genus Penaeus from the western Atlantic. Proc.biol.Soc.Wash., 80(14):83–100
Pérez-Farfante, I., 1969 Western Atlantic shrimps of the genus Penaeus. Fishery Bull.U.S. Fish Wildl.Serv., 67(3):461–591
Pérez Farfante, I., J.T. Acosta Jiménez y M.Alemany Proenza, 1961 Datos sobre la biología pesquera del camarón Penaeus duorarum Burkenroad. Ser.Estud.Inst.cub.Invest.Tecnol., (2):76 p.
Pericchi López, J.J., 1965 La industria del camarón en Venezuela. Corporación Venezolana de Fomento, Sub-Gerencia de Servicios Técnicos, Unidad de Estudios, 74 p.
Richardson, I.D. and M.N. Moraes, 1960 A first appraisal of the landing and mechanism of the Santos Fishery. Bolm Inst.Oceanogr., S Paulo, 11(1): 5–85
Sadowski, V. y A. Radasewski, 1960 Dados sôbre modificação do pêso do camarão, provocada pelo método de conservaçao empregado no entreposto de pesca de Cananéia. Contrções Inst.oceanogr. Univ.S Paulo(Tecnol.), (1):5 p.
Seba, A., 1759 Locupletissimi rerum naturalium thesauri accurata descriptio et iconibus artificiosissimis expressio per universam physices historiam, 3:1–212, lam. 1–116
Suárez Caabro, J.A., 1959 Salinidad, temperatura y plancton de las aguas costeras de Isla de Pinos. Monografías Lab.Biol.mar., Havana, (7): 30 p.
Tremel, E. y M.N. Mistakidis, 1965 Algumas observações sobre a pesca do camarão no Estado de Santa Catarina (1961–1963). Florianópolis, S. Catarina, Departamento Estadual de Caça e Pesca, 5 p. (mimeo)
Tremel, E. et al., 1964 Relatório de projeto de pesca exploratória na costa de Santa Catarina, Janeiro-Fevereiro, 1963. Florianópolis, S. Catarina, Departamento Estadual de Caça e Pesca, 46 p.
Anon., 1962 British Guiana: fishery trends, 1961. Comml Fish.Rev., 24(7):55–7