CHAPITRE 10 - Infestations des poissons par des vers nématodes | 93 | ||
10.1 | Infestations et lésions par des nématodes larvaires | ||
| ILLUSTRATIONS: | Planches 18 et 19 | ||
| ESPECES TOUCHEES: | Potentiellement toutes les espèces de poissons d'eau douce et saumâtre, les infections les plus graves touchant les poissons prédateurs. Des lésions et des déformations des gonades n'apparaissent que sur les Cichlidés du genre Haplochromis. | ||
| SIGNES APPARENTS: | Capsules de tailles variables dans les tissus, nécroses dans le derme, l'hypoderme et les viscères; gonades déformées ou atrophiées. Des vers ronds, rouges ou blancs, sont trouvés dans les capsules et dans les lésions. On trouve également des vers libres dans les cavités abdominales et péricardiales ainsi que dans le sinus venosus. | ||
| CAUSE: | Infestation par des nématodes larvaires, plus communément des genres Contracaecum et Amplicaecum (Hétérochéilidés) et du genre Eustrongylidés (Dioctophymidés). Ce dernier genre cause des lésions dans le derme et les viscères et la déformation des gonades. | ||
| DIAGNOSE: | L'identification des larves de nématodes, particulièrement au niveau des espèces, est difficile et souvent impossible parce que les larves sont privées de beaucoup de caractères, principalement du système génital, utilisés comme critères taxonomiques chez les nématodes. La diagnose générique est moins difficile et le lecteur doit se référer à la littérature spécialisée dans la taxonomie des nématodes ou consulter des experts en la matière. Pour l'identification générique, les nématodes enkystés doivent être soigeusement extraits de leur capsule avant que le tissu soit fixé, par une dissection minutieuse ou par la digestion des capsules dans une solution de pepsine (à 37°C). Beaucoup de ces larves émergeront spontanément des kystes après la mort du poisson. Les kystes isolés peuvent aussi être incubés dans une solution salée, à 37°C, pendant plusieurs heures jusqu'à l'émergence des larves. | ||
| Les larves libérées doivent être fixées dans une solution chaude de formol à 4 % et ensuite conservées dans la même solution. Pour l'étude microscopique, les nématodes doivent être clarifiés dans de la glycérine ou, mieux, dans du lactophénol. Les larves de nématodes peuvent être facilement détectées (mais non différenciées taxonomiquement) par une préparation histologique des tissus gr�ce à leur structure histologique distincte. Les Hétérochéilidés peuvent être différenciés des Dioctophymidés comme suit: | |||
| (a) | Heterocheilidae: oesophage relativement court, structurellement très distinct de l'intestin; chez les membres de la plupart des genres, il se termine distalement par un ventricule postérieur (bulbe musculaire); | ||
| (b) | Dioctophymidae (y compris le genre Eustrongylides) oesophage très long et presque indistinct de l'intestin, ventricule postérieur absent. | ||
| Les genres des Hétérochéilidés larvaires peuvent être différenciés comme suit: | |||
| (a) | Contracaecum: ventricule postérieur présent, duquel part un appendice, caecum intestinal présent; | ||
| (b) | Porrocaecum: ventricule présent, appendice ventriculaire absent, caecum intestinal présent; | ||
| (c) | Amplicaecum: ventricule absent, appendice absent, caecum intestinal présent. | ||
| DIAGNOSTIC DIFFERENTIEL: | Les capsules formées par les nématodes doivent être différenciées de celles contenant des cnidospores, des larves d'helminthes autres que nématodes, des nématodes filaroïdes et des tumeurs. La déformation et l'atrophie des gonades causées par les nématodes doivent être différenciées de celles, semblables, provoquées par les Myxosporidies. | 94 | |
| BIOCYCLE ET EPIZOOTOLOGIE: | Les biocycles des nématodes hétérochéilidés et dioctophymidés infestant les poissons africains n'ont pas été étudiés jusqu'alors. Les premiers hôtes intermédiaires des nématodes hétérochéilidés sont des petits crustacés: copépodes ou amphipodes. Le premier hôte intermédiaire d'Eustrongylides est inconnu. Quelques dictyphymidés sont connus comme se développant dans les oligochètes. Les larves de Contracaecum, Porrocaecum et Eustrogylides se développent en forme adulte dans les oiseaux piscivores. Les hôtes définitifs de ces nématodes sont, en Afrique, des hérons, des pélicans et des grèbes. Les hôtes définitifs d'Amplicaecum, en Afrique, sont les varans du Nil (Varanus niloticus). Les serpents aquatiques, les crocodiles, les grenouilles et les crapauds. Les crocodiles sont les hôtes définitifs de certains Porrocaecum et d'un autre hétérochéilidé: Dujardinascaris. D'autres membres de ce dernier genre se transforment en adultes dans les poissons piscivores (Malapterurus electricus et Gymnarchus niloticus). | ||
| Eustrongylides larvaires et quelques représentants larvaires de Contracaecum enkystés dans le poisson, se réenkysteront dans leur nouvel hôte s'ils sont ingérés par un autre poisson. Ceci permet aux larves de nématodes de s'accumuler dans le poisson prédateur aux plus hauts niveaux trophiques de la chaîne alimentaire dans l'habitat considéré. | |||
| Eustrongylides (vraisemblablement E. africanus), dans le lac Victoria, a été trouvé dans 77 % des Bagrus docmac examinés, avec une charge moyenne de plus ou moins 26 à 29 vers par poisson infesté (avec un maximum de 125 vers). Les niveaux d'infection se sont accrus significativement avec la taille (l'�ge) du poisson. On a vu aussi de fortes infestations chez Clarias mossambicus et Protopterus aethiopicus. Chez Haplochromis spp., l'incidence de l'infection ne fut que de 27 % (17 à 52 % dans les différentes espèces), avec une charge moyenne de plus ou moins 5,1 à 9,3 vers par poisson infesté (avec un recouvrement maximum de 17). | |||
| Dans le lac Victoria, les petits cichlidés sont les proies principales de B. docmac et de C. mossambicus. Ils sont également les proies principales des oiseaux piscivores: cormorans et hérons, hôtes définitifs d'Eustrongylides. B. docmac et C. mossambicus sont trop grands pour être la proie de ces oiseaux et, par conséquent, les vers sont piégés dans ces poissons sans aucune chance d'atteindre leur maturité dans l'hôte définitif; de tels poissons peuvent jouer un rôle important dans l'équilibre des niveaux d'infestation dans les lacs. | |||
| On n'a constaté une infestation suivie de dégénérescence des testicules et des ovaires que chez Haplochromis du lac Victoria; cette situation a été trouvée sur les représentants de 6 des 15 espèces examinées, toutes hôtes d'Eustrongylides. Bien que l'infection par les nématodes se manifeste aussi dans le lac George, les gonades ne se sont trouvées affectées dans aucun des poissons infestés: leur taux de lésion varie de 5 à 17 % chez les différentes espèces d'Haplochromis. On a démontré que la prévalence des gonades déformées et le nombre de vers infectant les gonades étaient statistiquement associés au nombre total de vers hébergés par individu et qu'ils étaient significativement plus abondants et prévalents dans les espèces de poissons ayant une plus forte incidence et une plus forte charge d'infestation. | 95 | ||
| Dans le Nil soudanais, les infestations par des larves d'Amplicaecum apparaissent dans la cavité abdominale de prédateurs comme Clarias lazera, Bagrus spp., Polypterus spp., Schilbe spp., Malapterurus electricus, Lates niloticus et Alestes nurse, avec des niveaux d'incidence de 10 à 37 % et une charge en vers de 5 à 36 par poisson. Contracaecum larvaire, qui s'enkyste dans le mésentère et dans la séreuse intestinale, se manifeste dans les lacs d'Afrique de l'Est et dans les barrages d'Afrique du Sud chez les poissons prédateurs des genres Bagrus, Clarias, Eutropius Hydrocynus, ainsi que chez les cichlidés (Tilapia et Haplochromis spp.). | |||
| Les nématodes larvaires des autres espèces de Contracaecum et Amplicatum montrent une spécificité plus réduite vis-à-vis de l'hôte et une plus haute prédilection en faveur d'un tissu ou d'un organe de l'hôte: les grandes larves de Contracaecum 1 (20 à 45 mm de long) qui ont une préférence pour la cavité péricardique, se présentent dans les lacs d'Afrique de l'Est dans Tilapia spp. et aussi, rarement, dans Haplochromis spp. et dans B. docmac. L'incidence de l'infection par ces nématodes larvaires dans T. leucosticta du lac Naivasha a atteint 85 % avec une intensité moyenne de 9 vers par poisson; chez T. nilotica du lac Baringo, l'incidence a atteint 70 % avec une moyenne de 5 vers par poisson; chez T. grahami des lacs Magadi et Nakuru au Kenya il a atteint 30 %, avec une moyenne de 2 vers par poisson et chez T. nilotica du lac George, en Ouganda, il fut de 30 %, avec une moyenne de un ver par poisson. | |||
| L'incidence de l'infestation chez T. nilotica du lac George s'est accrue avec la taille du poisson (35 à 70 mm = 4 %; 80 à 100 mm = 32 %; 270 à 350 mm = 30 %) et les vers semblent plus grands dans les grands poissons (18 ± 12 mg chez les poissons de 80 à 110 mm; 62 ± 12 mg chez ceux de 270 à 350 mm). Les larves d'Amplicaecum ayant une préférence pour le sinus venosus ne se sont manifestées dans le Nil soudanais que dans Tilapia spp., dans 69 à 94 % des poissons examinés, avec une intensité de 3 à 8 vers par poisson. | |||
| PATHOLOGIE: | Les effets des nématodes larvaires sur l'hôte sont variables. Les changements pathologiques causés par les larves encapsulées (de Contracaecum et d'Eustrongylides) sont ordinairement des modifications tissulaires conduisant à la formation de capsules fibreuses Les capsules peuvent également être formées par la prolifération de macrophages qui constitueront une capsule épithéliale. L'extension des dommages dans le tissu de l'hôte est provoquée par les larves non encapsulées d'Eustrongylides, qui envahissent l'hypoderme, les muscles somatiques et la gaine musculaire de l'intestin. Les lésions autour des vers non encapsulés dans le tissu consistent en dégénérescence cellulaire progressive et en nécrose quand le pourtour de la lésion est infiltré par des fibroblastes et par des lymphocytes. Des changements cellulaires sévères ont également été observés autour des kystes d'Eustrongylides logés dans la rate et dans les gonades. Le tissu autour du kyste est infiltré par des fibroblastes ou bien remplacé par des cellules adipeuses. Ces changements cellulaires peuvent être aussi étendus que la plus grande partie de l'organe affecté. | ||
| En dépit de ces changements pathologiques, le dommage total subi par de grands poissons comme Clarias et Bagrus sp., sont mineurs même lors de graves infestations (au-delà de 100 larves). Seul, un Bagrus docmac qui hébergeait 125 vers était sévèrement amaigri (avec un facteur de condition particulièrement bas de 0,99 au lieu de 1,61 en moyenne). L'amaigrissement a été rarement observé sur des Haplochromis infestés et les quelques poissons maigres ne portaient pas de vers au delà de la charge moyenne. Un Haplochromis mort, du lac Victoria, contenait 55 Eustrongylides et 200 Contracaecum (également 50 cestodes larvaires et plus de 100 spécimens du nématode adulte Rhabdochona congolensis dans l'intestin). Le dommage aux gonades infectées par Eustrongylides était très notable. | 96 | ||
| Une infestation précoce et bénigne a causé une déformation significative des ovaires et testicules mais sans toucher cependant la partie fonctionnelle de l'organe produisant respectivement les spermatozoïdes et les ovules. Les gonades infectées peuvent subir toutefois une dégénérescence et une atrophie; le tissu fonctionnel peut être remplacé par des tissus fibreux ou lipidiques et par une substance nécrotique amorphe. L'infection par Eustrongylides peut donc entraîner une stérélisation totale ou partielle. | |||
| Les vers encapsulés dans les cavités abdominale et péricardique ainsi que dans le sinus venosus ne causent apparemment pas de dommage pathologique au poisson-hôte. Aucune corrélation significative ne peut être établie entre le poids du poisson et l'intensité de l'infection chez T. leucosticta du lac Naivasha, parasité par Contracaecum infestant la cavité péricardique, ni chez B. docmac du lac Victoria infesté par Eustrongylides. | |||
| TRAITEMENT ET CONTROLE: | La prophylaxie environnementale est difficile, sinon impossible; on ne peut empêcher les oiseaux piscivores, hôtes définitifs, d'approcher des étangs piscicoles. L'extermination totale de ces oiseaux ne peut être recommandée et, n'importe comment, ne peut guère être menée à bonne fin. | ||
| DISTRIBUTION GEOGRAPHIQUE CONNUE: | On a signalé les formes encapsulées de Contracaecum dans des poissons des lacs Victoria, Albert, Kivu, ainsi que du Nil (au Soudan et en Egypte), du Niger (au Mali) et de barrages, au Transvaal. On a signalé aussi les formes non encapsulées de Contracaecum dans la cavité péricardique de poissons des lacs George, Victoria, Naivasha, Nakuru, Baringo et Magadi. Des infections par Eustrongylides on été notées dans les lacs Victoria, George, Kivu, Albert, Tanganyika et Tchad. L'infection par Amplicaecum de la cavité abdominale et du sinus venosus ne fut signalée que dans le Nil soudanais. Dujardinascaris a été signalé au lac Tanganyika et Porrocaecum dans le système du Congo. On n'a que des données limitées provenant d'Afrique de l'Ouest. Les nématodes larvaires n'ont pas été enregistrés dans l'examen parasitologique des poissons du bas Niger. | ||
| REFERENCES: | 20, 28, 118, 152, 193, 205, 206, 275. | ||
10.2 | Les poissons hôtes définitifs de Nématodes | 97 | |
| On a enregistré dans les poissons africains jusqu'à 40 espèces de nématodes adultes appartenant à 18 genres représentants de 9 familles. Parmi ces nématodes, plusieurs n'ont aucune prédilection particulière pour des espèces d'hôtes et se rencontrent dans un large éventail d'hôtes de diverses familles de poissons. Les meilleurs exemples en sont: Procamallanus laevionchus (Camallanidés), signalé jusqu'alors dans des poissons de six familles différentes, Rhabdochona congolense (Rhabdochonidés), signalé dans des poissons de huit familles et Spinitectus allaeri (Rhabdochonidés) signalé dans des poissons de six familles. Les autres nématodes, même des mêmes genres et familles, montrent un plus haut degré de spécificité quant à l'hôte, avec des préférences fixées aux membres d'une même famille de poissons ou de familles très voisines. Un haut degré de spécificité est évident chez les Kathlanidés, Trichuridés, Oxyuridés, Cuculanidés, Hétérochéilidés et Philomètridés. | |||
| Les nématodes vers ronds ont une forme très distincte. L'adulte chez l'hôte définitif, est ordinairement grand et visible à l'oeil nu. La plupart sont des parasites du système alimentaire. De toute les formes connues trouvées chez les poissons en Afrique seuls les membres de la famille des Philométridés envahissent les tissus. On trouve Thaiwaitia bagri sous la peau de Bagrus bayad et Nilonema gymnarchi envahit les parois des vésicules pulmonaires de Gymnarchus niloticus. On remarque plus facilement les nématodes que les autres endoparasites. Grâce à leur cuticule, ils sont relativement résistants aux enzymes autolytiques post-mortem dans le poisson mort et restent vivaces et actifs alors que tous les autres endoparasites des tissus et du tractus alimentaire sont détruits. | |||
| Les nématodes collectés doivent être fixés dans du formol chaud (80 à 90°C) ou dans de l'AFA (pour assurer un relâchement de l'individu) et conservés dans du formol à 4 % ou de l'alcool à 70 % mélangé à 1 % de glycérine pour éviter un déssèchement accidentel. Les très grands nématodes (plus de 50 mm) doivent être fixés dans du formol froid à 4 % ou de l'AFA, car la solution chaude pourrait endommager leur cuticule. Pour une identification spécifique, ou même générique, le matériel doit être soumis de préférence à l'examen de nématodologistes spécialisés. | |||
| BIOCYCLE ET BIOLOGIE: | Le biocycle de la majorité des nématodes parasites du poisson comprend un hôte invertébré, crustacé ou insecte aquatique. Les oxyuridés, toutefois, se développent directement. Les poissons s'infestent quand les oeufs embryonnés sont ingérés avec leur nourriture. | ||
| Les Camallanidés sont ovovivipares. La larve nouvelle-née, lâchée dans l'eau avec les fèces de l'hôte définitif, envahira la cavité du corps quand elle sera ingérée par un hôte copépode approprié. Elle se développera alors après deux mues en larve infectieuse (des espèces mentionnées ci-dessus) en six à neuf jours à 22–25°C. | |||
| Mesocyclops leuckati est l'invertébré hôte intermédiaire pour les Camallanidés Paracamalanus cyathopharynx et P. laevionchus. On doit noter que les larves de cette dernière espèce, qui montre une large tolérance envers l'hôte définitif, sont hautement spécifiques et ne réussissent pas à se développer dans les cladocères ni même dans les autres espèces de copépodes (du genre Cyclops et Diaptomus) | |||
| Chez les Camallanidés on trouve le phénomène de l'“hôte réservoir”. Les larves infectieuses, quand elles sont ingérées avec leurs hôte-copépode par un poisson impropre comme hôte définitif petit poisson ou, chez des nématodes davantage spécifiques, poissons d'une espèce différente - après avoir abandonné le copépode, se fixent à la paroi intestinale et restent vivantes pendant une période prolongée. Ces larves au repos atteindront le stade mature quans elles seront ingérées - avec leur “hôte réservoir” - par poisson, hôte définitif à leur convenance. Gambusia affinis a été utilisé expérimentalement comme hôte réservoir pour P. laevionchus. | 98 | ||
| Les copépodes servent d'hôtes intermédiaires pour les Philométridés. Les invertébrés-hôtes intermédiaires de Capillaria (Trichuridés) et des Hétérochéilidés, sont des copépodes ou des amphipodes. Chez les Rhabdochonidés (Rhabdochona et Spinitectus) des insectes aquatiques - larves d'Ephémèroptères - sont les hôtes intermédiaires. Chez les Hétérochéilidés (Dujardinascaris et Raphiascaroides), le poisson est le second hôte intermédiaire. | |||
| Il n'y a pas besoin de second hôte intermédiaire pour accomplir le développement larvaire des Trichuridés, Rhabdochonidés ou Philomètridés. Ces derniers sont histozoïques. Les femelles sont ovovivipares. La femelle de Thwaitia bagri, trouvée sous la peau, quand elle devient gravide, extrude son extrémité postérieure au travers de la peau et expulse les larves dans l'eau. Cette méthode est inconnue chez Nilonema. | |||
| Chez plusieurs philomètridés étudiés en Amérique, il a été montré que la maturation des nématodes était synchronisée avec celle de l'hôte et vraisemblablement influencée par les hormones de l'hôte. L'apparition de Thwaitia bagri est cantonnée de décembre à février dans le Nil soudanais. | |||
| PATHOLOGIE: | En dépit de leur relative abondance, les adultes entraînent rarement un dommage histologique et physiologique apparent dans les intestins de leur hôte définitif. Ceci s'oppose au dommage considérable qui peut être induit par les larves de nématodes infestant le poisson. Même les camallanidés, avec leur capsule buccale dure fixée à la muqueuse intestinale, ne causent pas plus qu'une lésion locale, quand il y en a une, à leur point de fixation. | ||
| Les vers philomètridés, dans le tissu ou dans les cavités du corps, peuvent provoquer une réaction inflammatoire et une fibrose, spécialement quand ils sont inactifs après la fin de la ponte ou après la mort. Une réaction tissulaire et une éventuelle encapsulation apparaissent aussi autour des vers femelles immatures mourant lors de la migration dans les tissus. On a signalé chez les fingerlings d'Heterotis niloticus élevés au Cameroun des modifications pathologiques causées par des vers philomètridés, avec des mortalités importantes. Les vers “filaroïdes” ont été localisés dans des kystes de l'opercule. | |||
| PREDOMINANCE ET DISTRIBUTION GEOGRAPHIQUE CONNUE: | Dans les poissons du Nil soudanais, les camallanidés, particulièrement Procamalanus laevionchus sont prédominants. Ces derniers se manifestent dans un large éventail d'hôtes (15 espèces et six familles) avec un taux de 50 % et des niveaux d'infection jusqu'à 37 spécimens par poisson. Moins abondants sont les autres camallanidés, Spirocamallanus spiralis, trouvés seulement sur les siluroïdés et Paracamallanus cyathopharynx, spécifique des Claridés. Ces trois camallanidés se manifestent sur les poissons du Nil inférieur, en Egypte. P. laevionchus et P. cyathopharynx apparaissent aussi dans Clarias lazera en Israël. P. laevionchus a été signalé en Afrique de l'Ouest, dans le bassin du Tchad et dans les lacs de l'Afrique orientale. | ||
| L'oxyure Citharinella citharinella est très abondant dans son hôte spécifique, le poisson Citharinus citharus. Dans le Nil soudanais, on a signalé une prédominance de l'infection de 54 %, avec des charges de plus de 130 vers par poisson. De fortes infections ont été signalées sur le même poisson-hôte dans le Niger inférieur. | 99 | ||
| Les espèces du genre Spironura (Kathalanidés) sont également abondantes dans les poissons du Nil soudanais. La prévalence de l'infestation chez les espèces de Distichodus s'établit entre 30 et 80 %, avec des charges de 120 nématodes par poisson. Rhabdochona congolense et quelques espèces de Spinitectus sont communes dans les poissons des lacs Victoria, Edouard et Albert. Ils ont aussi été signalés dans le Nil soudanais. R. congolense est commun chez les cichlidés des lacs d'Afrique orientale. On a trouvé 100 R. congolense, de nombreux nématodes larvaires enkystés (Eustrongylidés et Contracaecum) ainsi que des cestodes larvaires dans un Haplochromis du lac Victoria, moribond, pesant 106 g. | |||
| Les nématodes philomètridés (Thwaitia bagri et Nilonema gymnarchi), sont également prédominants (35 et 66 % respectivement) dans leurs hôtes spécifiques, dans le Nil soudanais, quoique le nombre de nématodes dans chaque poisson infesté ait toujours été inférieur à 10. | |||
| REFERENCES: | 28, 74, 118, 121, 123, 157, 176, 177, 178, 233, 275, 281. | ||
1 Identifié par l'infestation expérimentale de cormorans tels que C. spiculigerum
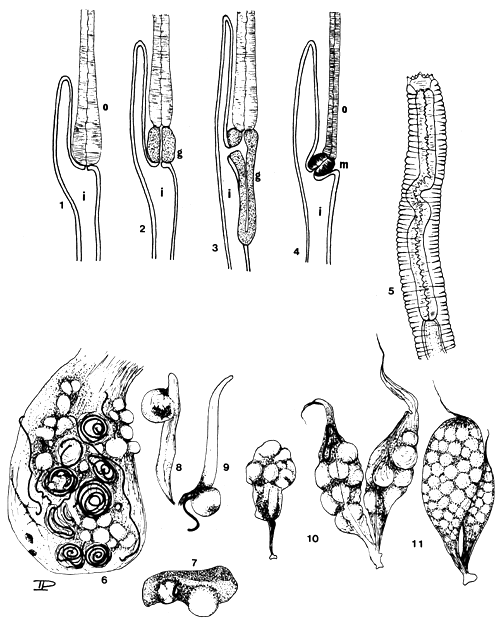
| PLANCHE 18: FORMES LARVAIRES DE NEMATODES Position et structure de l'oesophage (o), de l'intestin (i) et du ventricule (glandulaire -g- ou musculaire -m-) dans les larves d'hétérocheilidés (No 1 à 4). | |
| 1. | Amplicaecum |
| 2. | Porrocaecum |
| 3. | Contracaecum |
| 4. | Dujardinascaris |
| 5. | Extrémité antérieure de larve d'Eustrongylidés |
| 6. | Prolifération de nématodes larvaires dans l'estomac d'un Bagrus docmac - Eustrongylides (large, rouge) et Contracaecum (petit, encapsulé) |
| 7. | Rate d'Haplochromis sp. contenant des larves encapsulées d'Eustrongylides |
| 8–9. | Testicules d'Haplochromis sp. contenant des larves encapsulées d'Eustrongylides |
| 10. | Ovaire d'Haplochromis sp. infecté par de nombreuses larves d'Eustrongylides |
| 11. | Ovaire non infecté d'Haplochromis sp. |
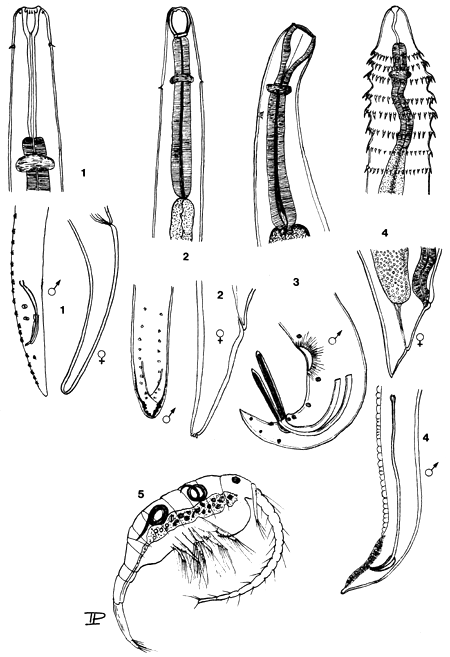
PLANCHE 19: VERS NEMATODES, d'après Moravec