La información siguiente es resumida de Lahille, 1929 y Nelson, 1984.
El pejerrey pertenece a la Familia Atherinidae.
Cuerpo: alargado, fusiforme, más o menos comprimido. Costillas en relación con parapófisis muy fuertes. Vértebras pueden variar de 32 a 60; faja plateada longitudinal lateral siempre presente.
Escamas: medianas o pequeñas; ordinariamente cicloideas.
Cabeza: aplanada superiormente; boca terminal hendida oblicuamente, premaxilar generalmente muy protráctil. Maxilar excluido del borde la maxila superior y terminado en punta en su extremidad posterior.
Linea lateral: dividida, nunca completa. A veces se ven a distintos niveles fragmentos de linea lateral.
El aparato branquial: Opérculo sin espinas ni puntas; mejillas y piezas operculares escamosas. Agallas anchas, membranas branquiostegas separadas del istmo. Cuatro branquias con un surco detrás de la cuarta. Pseudobranquias presente.
Poseen dos aletas dorsales bien separadas. La anterior con tres a ocho espinas delgadas y flexibles; la posterior membranosa. Aletas ventrales pequeñas mas o menos distantes de las pectorales. Inserción de las pectorales muy elevada, encontrándose a nivel del ángulo postero superior del opérculo. Aleta anal con una espina débil, caudal en horqueta.
El aparato digestivo: Premaxilares protráctiles; boca que se abre en embudo. Rastrillo branquial con 5 pares de branquiespinas. Se calcula que la mayor eficiencia de filtrado se sitúa para partículas desde alrededor de 1 mm. Poseen placas faríngeas para la trituración de moluscos y crustáceos decápodos. El tubo digestivo: relación long. intenstino a longitud del cuerpo: 1.3. Estómago corto, simple, un poco más ancho que el intestino. Sin ciegos pilóricos.
La vejiga natatoria: Presente, alargada, extendiéndose a menudo detrás del ano en un canal formado por las vértebras caudales.
Coloración. Blancos, comúnmente con faja plateada muy brillante (estola) situada a lo largo de los costados.
Area de distribución original. El pejerrey bonaerense (Odontesthes bonariensis) es originario de Argentina, Uruguay y Sur de Brasil. En la Argentina predomina en lagunas de la región pampeana y penetra en los sistemas de los ríos Paraná, Uruguay y de la Plata.
Area de dispersión actual. Actualmente el pejerrey se encuentra en una amplia región de Sudamérica que comprende además de los países mencionados anteriormente, el altiplano boliviano y la sierra Peruana. Ha sido introducido en Italia en lagunas cercanas a Roma (Brunner, A., comunicación personal). Japón (Ing. Inove, comunicación personal) e Israel para ser probado como pez de cultivo en estanques (Hephert, 1981).
La alimentación es planctívora con predilección por zooplancton (Cladóceros y Copépodos) por lo menos hasta el cuarto año de edad y a partir de entonces se observa un cambio hacia la piscivoría y canibalismo. Se registran como rubros importantes entre las preferencias del pejerrey, camarones de agua dulce (Palaemonetes argentinus) y pequeños caracoles (Littoridina), así como restos de vegetales e insectos.
Se señalan como importantes renglones en el tubo digestivo de pejerreyes de 350 mm a las algas filamentosas (probablemente ingeridas) y fragmentos vegetales (Potamogeton, semillas). También se han encontrado cianofíceas. En la alimentación de alevinos hasta 60 mm, son importantes los copépodos.
Merece la mención (Viruez Mardini y Porto da Silva, 1979) de la importancia cualitativa y cuantitativa que insectos del tipo efeméras revestirían en la alimentación natural de pejerreyes en estanques y embalses del sur de Brasil.
Vila, I. y D. Soto. 1979. reportan ingestión de microalgas en la dieta de los pejerreyes en Chile: especialmente diatomeas (Melosira granulata, Navicula sp). cianofíceas (Lyngbya sp., Oscillatoria sp) y Mycrocystis aeruginosa.
Esta ingesta de Mycrocystis por parte del pejerrey ha sido también observada en un embalse artificial de la Argentina (Dique San Roque, Pcia. de Cordoba) cuyas aguas eutroficadas llegan a cubrirse casi completamente con una capa de (Mycrocystis sp.). Se ha constatado que en tales ocasiones el tubo digestivo de los pejerreyes se encuentra ocupado, frecuentemente a repleción, por densos agrupamientos coloniales de estas microalgas. Debido a que en tales circunstancias no existe prácticamente zooplancton (las cianofíceas coloniales son demasiado voluminosas para poder ser filtradas por los microcrustáceos) y que por ende los pejerreyes se encuentran sumamente debilitados, es muy probable que los mismos hayan acudido a la ingesta de cianofíceas como recurso extremo. No se han realizado estudios para evaluar la digestibilidad de cianofíceas en pejerrey; tal como ocurre en tilapias (Oreochromis niloticus y O. mossambicus) las cuales pueden digerir cianofíceas (Microcystis) con una elevada eficiencia de asimilación (Getachew, T. 1987).
El mismo grupo de trabajo estudia las variaciones del régimen alimentario a través de las diferentes edades. Se reconocen cuatro etapas: 1) larval: consumo de vitelo 2) post-larval y hasta los tres meses: microcrustáceos (Copépodos y Cladóceros). diatomeas y otras algas. 3) hasta cuatro-cinco años: microcrustáceos planctónicos con algas; otros grupos. 4) más de cuatro años: canibalismo.
Vera, J. et al. (1989), analizan los hábitos alimentarios del pejerrey en ambientes andinos. Califica al pejerrey como eurífago, con acentuada tendencia carnívora e ictiófaga en análisis de tubo digestivo realizados en la bahía de Puno del Lago Titicaca. En la zona pelágica del lago, el alimento está constituido casi íntegramente por zooplancton (Daphnia y Boekella). En ambientes lóticos de la región, la dieta del pejerrey se basa casi exclusivamente en insectos acuáticos, a nivel de larvas y pupas principalmente Chironomidae como también Notonectidae y Corixidae.
Freyre et al. (1983) determinan los índices de crecimiento y mortalidad en poblaciones de pejerreyes del embalse de Río Tercero, Pcia de Córdoba., Argentina. La información extraída proviene de la medición de 2 294 ejemplares. Los autores emplearon el modelo de crecimiento de Bertalanffy, y determinan la siguiente ecuación de crecimiento con t expresado como partes de año: (Figura 1)
Lt = 318 [1 e -0. 337813 (t+1. 571048)]
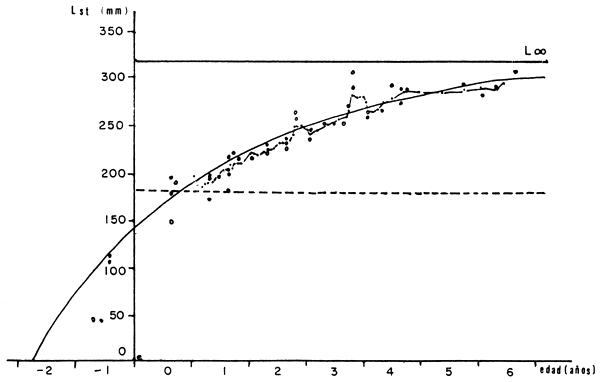
Figura 1. Curva de crecimiento. Extraído de Freyre et al., 1983.
Freyre et al. (1983), establecen para la relación longitud-peso la ecuación cuya expresión exponencial es la siguiente:
Wt = 5. 046-6 L3. 1629
(W: peso en g; A: ordenada al origen y L: longitud standard)
Rivas Plata y Llanos Urbina (1989) citan a Sarmiento et al. (1987) quienes establecen relaciones longitud-peso separadamente para machos y hembras tanto en el lago mayor como en el lago menor del Lago Titicaca. Las mismas al ser aplicadas para intervalos de L entre 100 y 270 mm dan valores del peso entre los cuales se encuentran comprendidos los obtenidos mediante la aplicación de la ecuación de Freyre et al.
Del análisis de la información anterior y de la existente para otros ambientes, especialmente las lagunas bonaerenses (Argentina) se pueden extraer conclusiones de importancia práctica. Así para alcanzar la talla dentro de la cual caen el 95% de las capturas en el Lago Titicaca (20 cm de log estandard y entre 95 y 100 g, se necesitarían entre 12 y 18 meses en condiciones climáticas (las de la Argentina central) marcadamente menos rigurosas que las prevalecientes en las regiones andinas.
Para los intervalos de talla comercializable más usual en la Argentina, por ejemplo 270 mm y 300 g, se necesitaría un lapso de dos a tres años.
La información anterior permite corroborar la calificación de especie de crecimiento lento (Hpeher y Pruginin, 1981) y debe ser tenida en cuenta al momento de evaluar estrategias de producción.
Calvo, J. y Dadone, L. (1972), analizan las gonadas de 1062 reproductores de ambos sexos capturados. Las conclusiones más importantes de los censos bimensuales efectuados entre los meses de mayo y diciembre de 1965 se discuten a continuación.
El análisis de las gonadas mostró que el período de reproducción transcurre entre agosto y noviembre (temperatura del agua en superficie: 13° a 21 C°) con un máximo situado en el período octubre–noviembre. La talla mínima de los reproductores fluctuó entre 103 mm (machos) y 194 mm (hembras).
Cuando se realizan los cálculos de fecundidad absoluta se encuentra que los valores obtenidos son excepcionalmente altos para las hembras adultas y que cada hembra del reservorio tiene en teoría la posibilidad de reproducirse al menos cinco veces durante el transcurso de su vida.
Para los testículos los valores del índice de madurez, relación de longitudes e índice gonadal van disminuyendo desde el principio de la temporada de freza hasta el fin de la misma, lo cual podría indicar un estado de emisión continua o casi continua de esperma durante la época del desove, con progresivo agotamiento del testículo.
Las ovas maduras libres en el lumen ovárico son de un diámetro de 1.65 a 1.88 mm, translúcidas, de color amarillo limón pálido con tintes verdosos; presentan gotas de aceite aumentadas de tamaño y reunidas en un solo grupo; los filamentos coriónicos están sueltos.
El pejerrey muestra dos períodos de actividad sexual: uno muy intenso en primavera y otro menos notorio en otoño. En la freza primaveral están involucradas la casi totalidad de las hembras.
Muchas de las hembras que desovan entre agosto y setiembre vuelven a frezar entre octubre y diciembre. Aunque la mayoría de las hembras desovan por lo menos una vez en primavera, solo la mitad de las mismas frezan en otoño nuevamente.
El análisis de la composición por tallas de las hembras maduras indica que las clases menores desovan a principios de la primavera, época durante la cual se observa un correlativo descenso en el Indice Gonadal (IG) en general, así como en el diámetro y número de las ovas, causado por el incremento porcentual de hembras de mayor tamaño dentro del grupo de las maduras.
Debemos agregar que durante ensayos de cría en estanques del pejerrey, se determinó que en peces sembrados como larvas, luego de transcurridos algo más de nueve meses (exactamente entre 270 y 280 días de edad) fue posible realizar el desove de hembras maduras (10% de las hembras) y fecundación artificial de las ovas (Reartes, 1987). En tal momento los índices de madurez para machos alcanzan su máximo para un 80% de los individuos.
Establecen zonas de preferencia durante la época de freza. Se comparan los muestreos realizados en dos zonas ecológicamente diferentes:
una zona de macrófitas emergentes arraigadas y sumergidas (“juncal” Scirpus californicus) y camalote (Potamogeton striatus). El fondo entre la vegetación consiste en una espesa capa de sedimento fino.
una zona desprovista de vegetación llamada localmente tosca (corresponde a la denominación inglesa de limestone). La superficie de la tosca es bastante lisa y dura y no hay acumulación de sedimentos de fondo.
Los autores establecen que en la época de reproducción las hembras y machos maduras se concentran en las zonas de tosca. Se llega a una conclusión similar con los machos maduros los cuales se concentran en la misma área. Para el período de estudio la proporción de machos sobre la población total es de 65%.
Rivas Plata y Llanos Urbina (1989) recopilan información que da cuenta de la presencia de nemátodes en la primera porción del estómago de pejerreyes del la go Titicaca, siendo su incidencia mayor en ejemplares de talla superior a los 21 cm. Zavaleta (en Rivas P. y Llanos U., 1989) determinan una parasitosis por cestodes en un 2.46% y por nemátodos en un 71.5%, al analizar una muestra de 407 ejemplares provenientes del lago Titicaca. En la observación microscópica de la mucosa gontoenterica de los peces parasitados no se detectaron daños considerables.
Hepher y Pruginin (1981) señalan que el pejerrey al ser introducido en Israel como pez de cultivo en estanques (actividad que no prosperó) mostró, bajo tales condiciones, ser muy susceptible a la infección por Lerneae. En la Argentina central ha sido frecuentemente señalada la infestación de pejerreyes por Myxosoma cerebralis, la cual puede llegar a afectar hasta el 100% de los individuos examinados.
Entre las aves predadoras merecen destacarse el benteveo (Pitangus sulphuratus). el martín pescador grande (Megaceryle torquata), el martín pescador chico (Chloroceryle sp), los cormoranes o biguaces (Phalacrocorax olivaceus) y las garzas (Nycticorax). El benteveo es especialmente audaz y en el caso de estanques nurseries si los mismos no están protegidos por redes puede diezmar los cultivos de alevinos y juveniles. El martín pescador preda asímismo sobre peces de mayor tamaño pero es más fácil disuadirlo mediante la colocación de líneas longitudinales de alambre liso sobre la superficie del estanque (situados unos 50 a 70 cm de distancia entre sí). Para el caso de estanques mayores y represas se debe apelar a balones inflables ahuyentadores.