
特性
生物学特征
体长,背部略微拱起,头部下斜。主要呈古铜色或微红,腹部发白。吻钝而较大,下颌有绒毛齿带。无触须,而这一点不同于与其紧密相关的多须石首鱼(Pogonias cromis)。两个背鳍,第一背鳍具有10枚硬刺而第二背鳍则有一枚硬刺和多个软鳍条(24)。尾鳍略呈凹形,侧线上方有1个或更多大而黑的色斑。在产卵季节,通过鱼鳔与特殊肌肉之间的摩擦,雄鱼发出特别的击鼓声。
图片库
 |
 |
红拟石首鱼 Sciaenops ocellatus |
红拟石首鱼 Sciaenops ocellatus |
主要情况

历史背景
由于对商业和休闲捕捞活动导致天然种群数量下降的忧虑,上个世纪70年代末人们开始对圈养红拟石首鱼产生兴趣。自那时起实施了各种管理性措施(如规格和袋 子的限制),而且在许多地区商业性捕捞被完全杜绝。最初的水产养殖方法由美国开发,特别是在得克萨斯州和佛罗里达州,目的是提供野生环境捕捞鱼类的替代产 品,并开展种群增殖工作。随着可靠养殖技术的发展,该鱼种的商业化生产已经扩大到其他国家,因为红拟石首鱼是一种受欢迎的食用鱼类,而且相对强壮,能够很 好地适应水产养殖条件。
主要生产国

主要生产国(粮农组织渔业统计数据,2006年)
生境和生物学
红拟石首鱼为广盐性鱼类,分布在大西洋和墨西哥湾沿岸,从马萨诸塞州的科德角半岛到墨西哥的图斯潘。成鱼的产卵季节为8-10月,地点通常在靠近进潮口的 沿海水域。红拟石首鱼所产的卵为浮性卵(直径约为1.0 mm),大个雌鱼可产卵>1百万枚。幼体(标准体长约为6-8 mm)随着水流达到河口并在那里的海草中定居。幼鱼和亚成鱼通常留在海湾及河口处,当它们长到3.5-5龄时便会游入近海并加入成鱼产卵种群的行列。
生产

亲体
在某些情况下,鱼卵和/或鱼苗从现有孵化场购买,作为维护和孵化亲鱼的另一方法。然而,红拟石首鱼对养殖环境的适应能力很强,因此许多生产者维持亲鱼种群 以确保用于养成阶段的幼体供应。可将成鱼养殖在一个外接过滤箱的圆形玻璃纤维水池(10 - 17 m3, 1.5 m高)中。在该系统中,采用同样性别比例可以使4-6条鱼成功产卵。通常每周使用鱼、鱿鱼、虾和/或颗粒饲料对亲鱼进行3-5次投喂。
在大多数生产红拟石首鱼的国家,亲鱼必须进口,因为这种鱼不属于地方鱼种。结果,在亲体数量有限的条件下,经过几年的养殖很可能发生遗传漂变,会对生产造成不利影响。为了保护养殖红拟石首鱼的遗传多样性,应当保持充足数量的个体和家系以尽可能减少近亲繁殖。
产卵
对于该鱼种已经开发出全年产卵技术。在养殖环境中,可以采用120天光周期和温度系统来繁殖红拟石首鱼。将亲鱼的水温调至17 °C并给予9小时光照周期,为自然发育的成鱼模拟冬季条件。当成鱼适应环境后,在120天时间里,将温度和光周期逐渐增加,然后再降低。
完成对亲鱼的初始环境调节之后便可通过调整温度来实现其全年有控制产卵。例如,当水温降至23 °C以下时,产卵停止,而当温度提高到23 °C以上,便可恢复产卵。红拟石首鱼通常在晚间熄灯后不久产卵。鱼卵漂浮在盐度超过25 ‰的水面上。将鱼卵连夜转至外接过滤池中,用~500微米的集卵袋进行采集。
将鱼卵从集卵器中取出,直接放入饲养池或在孵化器中(500-2 000升; 200-500 卵/升)进行初期孵化,然后将它们移入饲养池。用50-100 ppm福尔马林对鱼卵进行大约一小时消毒将有助于减少细菌和真菌滋生。鱼卵直径约为1 mm,在24-28 °C水温中于18-25小时之内孵化。
饲养系统通常使用装有环境控制装置的室内圆形纤维玻璃池,平均容积在5000-15000升之间。但也可以将首次开口摄食的幼体移入池塘进行养殖。养殖密 度在10-30 幼体/升之间,渡过幼体阶段的成活率可能在>50%。孵化和幼体养殖初期的最佳温度和盐度为25-30 °C 和25-30 ‰,但是对于更成熟幼体而言,所使用的范围可更广。例如,据报告在10 ‰、5 ‰ 和1 ‰的盐度条件下,相应的3 mm、6 mm 和15 mm幼体的成活率很高。幼体可在孵化场或池塘中饲养到养成放养规格。
幼体精养
红拟石首鱼的幼体在孵化时约2.2 mm SL,通常可以在孵化后饲喂3天(dph)。开始时使用轮虫喂养幼体,浓度为5-10/ml,3-10 dph,随后采用卤虫卵喂养11-15 dph。在此之后,将可以向幼体投喂微粒饵料,但是在幼体期最好同时采用活体和惰性饵料。另一种养殖红拟石首鱼的办法是先采用轮虫和惰性饲料混合物 (~0.25 mm,3-7 dph),随后换投单一的惰性饵料 – 逐步加大颗粒规格 – 但不会影响生长和存活。需要经常添加高度不饱和脂肪酸,如花生四烯酸(ARA)、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)来补充活体饵料,从而 改善生长和存活状况。频繁添加富集物,促进饵料脂肪酸的构成,其中包括活体微型海藻、微型海藻糊、商业制品和海洋鱼油。另一种促进幼体生长和存活的做法是 在养殖池中添加浓度为40 000 - 100 000 细胞/ml的微型海藻(Nannochloris occulata、Isochrysis galbana)。当幼体发育至幼鱼阶段便可将它们移入池塘或网箱进行养成。
面积在0.2-1.0公顷的池塘放养之前通常需要5-10天注水。向池塘中施撒无机和有机肥料可以促使浮游植物繁殖,而从另一方面又促成浮游动物(主要为 桡脚类动物)种群的生长。一旦浮游动物密度达到250生物体/升,便可将幼体(2 dph; 740 000/公顷)从孵化场移入池塘。它们在这类系统中暂养30 dph (~30 mm SL),随后移入较大的池塘或网箱。
红拟石首鱼的养成在网箱或池塘中进行。
池塘养殖
在二十世纪80年代末和90年代初,美国红拟石首鱼的池塘养殖受到冬季低温的严重影响,造成大量死亡。对红拟石首鱼幼鱼而言,致命的低温估计在8-10 °C之间,但亦取决于盐度和降温速度。为了防止低温导致的损失,养殖专家改进了生产规范。例如,当鱼的重量达到1克左右时,将它们移入室内的半封闭的再循 环系统,并在水温转暖后返回室外池塘(150-225 g)。自相残食的情况在鱼苗阶段比较明显;在室内养殖阶段经常对鱼苗进行分级有助于减少死亡率,从而提高总体产量。此类系统可在11个月里生产出上市规格 的产品(~1 kg)。
网箱养殖
海水鱼类的网箱养殖使用不同尺寸和类型的网箱。在中国,网箱的制作是将弹力网袋系在固定框架上,大小约1.5-2.5 m3。将红拟石首鱼的鱼种(0.2 g)以1000尾鱼苗/m3的密度进行放养。随着鱼的生长,可将它们移入较大的网箱,密度减至~400尾鱼苗/m3。自相残食是一个经常出现的问题,因此 应定期对鱼进行分级,以减少总的死亡率。产品通常在一年之内可达到上市规格(~1 kg))。
使 用各种专为红拟石首鱼或其它海洋暖水鱼类生产的配合饲料可以使鱼种生长良好。对营养方面的需要很明确。红拟石首鱼幼鱼的快速生长需要含有35-45%蛋白 质的饵料。膳食蛋白主要通过鱼粉提供,但如果能够保证供应至少10%的鱼粉粗蛋白,大豆粉亦可以作为替代物。与前面介绍的幼体情况那样,幼鱼需要膳食的高 度不饱和脂肪酸(HUFAs);建议在食用油脂中添加10%的n-3 HUFAs。有关该种类维生素和矿物质需要量的信息比较少,而这类成分一般通过为其它鱼类养殖开发的商业性预混剂来补充。用于红拟石首鱼的实用饵料通常含 有40%的粗蛋白质、5-7%的鱼油、<7%粗纤维,以及维生素和矿物质预混剂。
可以使用围网收获池塘养殖的红拟石首鱼。使用分级网在一个池塘中多次收获某种规格的鱼,可以提高整体产量。还可以采取干塘收获方式,将鱼集中在暂养池中, 这样更容易捕捞。就网箱养殖的红拟石首鱼而言,如使用抄网,可将网的底部略微提起使鱼集中来进行收获,或者将网提出水面。
Red drum may be harvested from ponds by seine. Multiple harvests from one pond using a grading seine that captures fish of certain sizes results in higher overall production. Alternatively, ponds may be drained and the fish collected in a holding basin from which they are more easily captured. Red drum may be harvested from cages with the use of dip nets following concentration of the fish by slightly raising one side of the bottom net or otherwise lifting the net out of the water.
在养殖的各个阶段和在收获和加工过程中都需要小心搬运红拟石首鱼,以便保持鱼品的营养价值和美观,同时避免污染。在加工之前、期间和之后,所有用来装运或 加工鱼品的设备均应得到适当保养和彻底清洗。应当与当地负责监督水产品处理和加工的管理部门取得联系,了解有关鱼品加工卫生方面的详细情况
以下对美国的红拟石首鱼养殖设施生产成本(大约一年时间在池塘中将鱼种从0.4 g 养成至1 kg)的相关分析来自1994年的报告。尽管报告的成本估算会由于通货膨胀等因素而不再有效,但决定估计数的因素及其相对重要性目前仍然适用。
生产周期

生产周期
生产系统
苗种供应
亲体
在某些情况下,鱼卵和/或鱼苗从现有孵化场购买,作为维护和孵化亲鱼的另一方法。然而,红拟石首鱼对养殖环境的适应能力很强,因此许多生产者维持亲鱼种群 以确保用于养成阶段的幼体供应。可将成鱼养殖在一个外接过滤箱的圆形玻璃纤维水池(10 - 17 m3, 1.5 m高)中。在该系统中,采用同样性别比例可以使4-6条鱼成功产卵。通常每周使用鱼、鱿鱼、虾和/或颗粒饲料对亲鱼进行3-5次投喂。
在大多数生产红拟石首鱼的国家,亲鱼必须进口,因为这种鱼不属于地方鱼种。结果,在亲体数量有限的条件下,经过几年的养殖很可能发生遗传漂变,会对生产造成不利影响。为了保护养殖红拟石首鱼的遗传多样性,应当保持充足数量的个体和家系以尽可能减少近亲繁殖。
产卵
对于该鱼种已经开发出全年产卵技术。在养殖环境中,可以采用120天光周期和温度系统来繁殖红拟石首鱼。将亲鱼的水温调至17 °C并给予9小时光照周期,为自然发育的成鱼模拟冬季条件。当成鱼适应环境后,在120天时间里,将温度和光周期逐渐增加,然后再降低。
完成对亲鱼的初始环境调节之后便可通过调整温度来实现其全年有控制产卵。例如,当水温降至23 °C以下时,产卵停止,而当温度提高到23 °C以上,便可恢复产卵。红拟石首鱼通常在晚间熄灯后不久产卵。鱼卵漂浮在盐度超过25 ‰的水面上。将鱼卵连夜转至外接过滤池中,用~500微米的集卵袋进行采集。
将鱼卵从集卵器中取出,直接放入饲养池或在孵化器中(500-2 000升; 200-500 卵/升)进行初期孵化,然后将它们移入饲养池。用50-100 ppm福尔马林对鱼卵进行大约一小时消毒将有助于减少细菌和真菌滋生。鱼卵直径约为1 mm,在24-28 °C水温中于18-25小时之内孵化。
孵化场
饲养系统通常使用装有环境控制装置的室内圆形纤维玻璃池,平均容积在5000-15000升之间。但也可以将首次开口摄食的幼体移入池塘进行养殖。养殖密 度在10-30 幼体/升之间,渡过幼体阶段的成活率可能在>50%。孵化和幼体养殖初期的最佳温度和盐度为25-30 °C 和25-30 ‰,但是对于更成熟幼体而言,所使用的范围可更广。例如,据报告在10 ‰、5 ‰ 和1 ‰的盐度条件下,相应的3 mm、6 mm 和15 mm幼体的成活率很高。幼体可在孵化场或池塘中饲养到养成放养规格。
幼体精养
红拟石首鱼的幼体在孵化时约2.2 mm SL,通常可以在孵化后饲喂3天(dph)。开始时使用轮虫喂养幼体,浓度为5-10/ml,3-10 dph,随后采用卤虫卵喂养11-15 dph。在此之后,将可以向幼体投喂微粒饵料,但是在幼体期最好同时采用活体和惰性饵料。另一种养殖红拟石首鱼的办法是先采用轮虫和惰性饲料混合物 (~0.25 mm,3-7 dph),随后换投单一的惰性饵料 – 逐步加大颗粒规格 – 但不会影响生长和存活。需要经常添加高度不饱和脂肪酸,如花生四烯酸(ARA)、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)来补充活体饵料,从而 改善生长和存活状况。频繁添加富集物,促进饵料脂肪酸的构成,其中包括活体微型海藻、微型海藻糊、商业制品和海洋鱼油。另一种促进幼体生长和存活的做法是 在养殖池中添加浓度为40 000 - 100 000 细胞/ml的微型海藻(Nannochloris occulata、Isochrysis galbana)。当幼体发育至幼鱼阶段便可将它们移入池塘或网箱进行养成。
育苗
面积在0.2-1.0公顷的池塘放养之前通常需要5-10天注水。向池塘中施撒无机和有机肥料可以促使浮游植物繁殖,而从另一方面又促成浮游动物(主要为 桡脚类动物)种群的生长。一旦浮游动物密度达到250生物体/升,便可将幼体(2 dph; 740 000/公顷)从孵化场移入池塘。它们在这类系统中暂养30 dph (~30 mm SL),随后移入较大的池塘或网箱。
养成技术
红拟石首鱼的养成在网箱或池塘中进行。
池塘养殖
在二十世纪80年代末和90年代初,美国红拟石首鱼的池塘养殖受到冬季低温的严重影响,造成大量死亡。对红拟石首鱼幼鱼而言,致命的低温估计在8-10 °C之间,但亦取决于盐度和降温速度。为了防止低温导致的损失,养殖专家改进了生产规范。例如,当鱼的重量达到1克左右时,将它们移入室内的半封闭的再循 环系统,并在水温转暖后返回室外池塘(150-225 g)。自相残食的情况在鱼苗阶段比较明显;在室内养殖阶段经常对鱼苗进行分级有助于减少死亡率,从而提高总体产量。此类系统可在11个月里生产出上市规格 的产品(~1 kg)。
网箱养殖
海水鱼类的网箱养殖使用不同尺寸和类型的网箱。在中国,网箱的制作是将弹力网袋系在固定框架上,大小约1.5-2.5 m3。将红拟石首鱼的鱼种(0.2 g)以1000尾鱼苗/m3的密度进行放养。随着鱼的生长,可将它们移入较大的网箱,密度减至~400尾鱼苗/m3。自相残食是一个经常出现的问题,因此 应定期对鱼进行分级,以减少总的死亡率。产品通常在一年之内可达到上市规格(~1 kg))。
使 用各种专为红拟石首鱼或其它海洋暖水鱼类生产的配合饲料可以使鱼种生长良好。对营养方面的需要很明确。红拟石首鱼幼鱼的快速生长需要含有35-45%蛋白 质的饵料。膳食蛋白主要通过鱼粉提供,但如果能够保证供应至少10%的鱼粉粗蛋白,大豆粉亦可以作为替代物。与前面介绍的幼体情况那样,幼鱼需要膳食的高 度不饱和脂肪酸(HUFAs);建议在食用油脂中添加10%的n-3 HUFAs。有关该种类维生素和矿物质需要量的信息比较少,而这类成分一般通过为其它鱼类养殖开发的商业性预混剂来补充。用于红拟石首鱼的实用饵料通常含 有40%的粗蛋白质、5-7%的鱼油、<7%粗纤维,以及维生素和矿物质预混剂。
捕捞技术
可以使用围网收获池塘养殖的红拟石首鱼。使用分级网在一个池塘中多次收获某种规格的鱼,可以提高整体产量。还可以采取干塘收获方式,将鱼集中在暂养池中, 这样更容易捕捞。就网箱养殖的红拟石首鱼而言,如使用抄网,可将网的底部略微提起使鱼集中来进行收获,或者将网提出水面。
捕捞技术
Red drum may be harvested from ponds by seine. Multiple harvests from one pond using a grading seine that captures fish of certain sizes results in higher overall production. Alternatively, ponds may be drained and the fish collected in a holding basin from which they are more easily captured. Red drum may be harvested from cages with the use of dip nets following concentration of the fish by slightly raising one side of the bottom net or otherwise lifting the net out of the water.
处理和加工
在养殖的各个阶段和在收获和加工过程中都需要小心搬运红拟石首鱼,以便保持鱼品的营养价值和美观,同时避免污染。在加工之前、期间和之后,所有用来装运或 加工鱼品的设备均应得到适当保养和彻底清洗。应当与当地负责监督水产品处理和加工的管理部门取得联系,了解有关鱼品加工卫生方面的详细情况
生产成本
以下对美国的红拟石首鱼养殖设施生产成本(大约一年时间在池塘中将鱼种从0.4 g 养成至1 kg)的相关分析来自1994年的报告。尽管报告的成本估算会由于通货膨胀等因素而不再有效,但决定估计数的因素及其相对重要性目前仍然适用。
| 经营费用 | 占年度费用比例 (%) |
| 饲料 | 55.5 |
| 鱼种养成阶段成本 | 19.3 |
| 劳力 | 14.3 |
| 化学品 (如肥料、疾病治疗) | 4.8 |
| 储存和销售 | 3.4 |
| 设备维修 | 2.7 |
病害和控制措施
T下表列出了养殖条件下红拟石首鱼所患疾病的信息。养殖人士应当熟悉当地有关批准用于食用鱼的具体化学品/药品的规定并了解产品进口国现行的法规。
在某些情况下,抗生素和其它药物被用于治疗,但将它们列入本表并不意味着是粮农组织的建议。
供病理学专业知识的单位
一般来讲,政府单位、私营公司和教育机构负责提供与水生生物疾病的诊断和治疗相关的服务。与当地负责养殖鱼类生产监督的部门联系,他们可帮助确定诊断设施。
在某些情况下,抗生素和其它药物被用于治疗,但将它们列入本表并不意味着是粮农组织的建议。
| 疾病 | 致病因子 | 类型 | 综合病症 | 措施 |
| 病毒性神经坏疽 | 诺达病毒 | 病毒 | 游动异常(螺旋、旋转);鱼鳔高度肿胀;颜色暗淡;摄食减少 | 治疗方法不详;批次之间对养殖系统进行消毒(养殖用水 – UV、臭氧;材料 - 氯);剔除病鱼 |
| 肠道粘液水肿 | 粘孢子虫 | 体内寄生粘孢子虫 | 孢子寄生在消化道黏膜中;消化道发炎;变色;鳞片脱落;皮肤溃疡 | 治疗方法不详;对养殖系统进行消毒;剔除病鱼 |
| 淋巴囊肿 | 虹彩病毒 | 病毒 | 皮肤、鱼鳍,有时鱼鳃上出现增大的白色和淡红色纤维原细胞(呈菜花状生长) | 治疗方法不详;对养殖系统进行消毒;鱼类检疫 – 有时鱼可以自行康复;降低放养密度 |
| 甲壳类体外寄生虫(海虱/鱼虱) | 桡脚类;等脚类;鳃尾类 | 体外寄生虫 | 小型甲壳类动物附着于鳃部、皮肤;皮肤溃疡 | 淡水浸泡(5-15分钟);福尔马林浸泡(30分钟, 2-4 ml福尔马林/10升水) - 未获准用于食用鱼 |
| 弧菌病(全身细菌感染) | 弧菌 | 细菌 | 腹部肿大;皮肤溃疡;体表出血;眼球凸出;无生气;内部损伤 | 通过水或食物施用抗细菌药物;剔除或治疗病鱼;对养殖系统进行消毒;减少应激 |
| 全身细菌感染 | 株链球菌 | 细菌 | 皮肤溃疡;败血病;眼球凸出;体表出血;颜色暗淡 | 通过水或食物施用抗细菌药物;剔除或治疗病鱼;对养殖系统进行消毒;减少应激 |
| 淀粉卵甲藻病(海洋绒状病) | 淀粉卵鞭虫 | 涡鞭毛虫 | 皮肤、鳍和/或鳃上出现滋养体(呈小白斑);衰弱;厌食;闪光;刮擦 | 淡水浸泡(5-15分钟);水箱冲洗(每日至少6箱);过滤(微型滤网、筒式/磁珠过滤器);硫化铜 -未获准用于食用鱼;福尔马林浸泡(30分钟, 2-4 ml福尔马林/10升水) - 未获准用于食用鱼 |
| 隐核虫病(海水白斑病/海水白点病) | 刺激隐核虫/白点虫 | 原冲,体外寄生虫 | 皮肤上呈薄薄一层白色粉末;呼吸困难;刮擦;蜕皮;摄食量减少 | 降低盐度(≤16 ‰ ,~14 日, ≤10 ‰ 三小时);低温<19 °C;硫化铜 -未获准用于食用鱼;福尔马林浸泡(30分钟, 2-4 ml福尔马林/10升水) - 未获准用于食用鱼 |
供病理学专业知识的单位
一般来讲,政府单位、私营公司和教育机构负责提供与水生生物疾病的诊断和治疗相关的服务。与当地负责养殖鱼类生产监督的部门联系,他们可帮助确定诊断设施。
统计
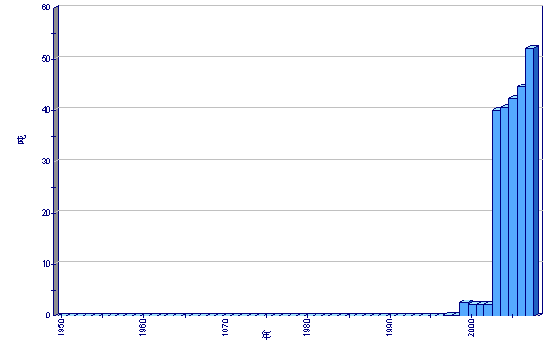
生产
全球养殖产量
粮农组织渔业统计
粮农组织渔业统计

市场和贸易
红拟石首鱼产业的主要产品是新鲜或冷冻鱼片和鱼排(170-340 g),但有时亦销售整鱼和去内脏鱼。同其它品种一样,供求情况决定市场的价格。目前美国商业化养殖场红拟石首鱼整鱼的售价是4.19-4.63美元/公斤。尚未获得有关中国同类产品的贸易信息。
状况和趋势
红拟石首鱼是一种耐受性强、生长速度相对较快的品种。已经着手处理与海水鱼类养殖相关的许多问题,而且很多难题(例如产卵、营养、环境耐受性)已经得到解 决。尽管如此,低温造成的高死亡率问题需要养殖人员对生产地点和/或采用的生产系统予以认真考虑。然而,随着水产养殖技术不断进步,红拟石首鱼的生产将会 通过现有养殖场效率的提高和向更多国家扩展而继续在世界范围提升。在饲料效率、疾病治疗、温度耐受性和水产养殖循环系统等领域开展的进一步研究将有助于确 保未来该鱼种的生产能够获得良好的生态和经济效益。
主要问题
在红拟石首鱼为外来品种的地区,从网箱和其它生产设施中逃逸的养殖鱼会因争夺资源,如食物和生境,对本地的动植物群落产生不利影响。在自然环境中(即网箱 /围栏)养殖外来鱼种带来的另一潜在问题是疾病向本地种群的转移;例如有迹象证明,在埃拉特湾(以色列)采集的野生鱼类(条纹石鲈 Pomadasys stridens 和杂斑狗母鱼 Synodus variegatus)分离出株链球菌特殊病株,这是一种外来病株,很可能源自附近网箱养殖的红拟石首鱼。
陆基生产活动的排放物和来自开放性水产养殖系统的剩余饲料/废物都会不利地影响周边环境。为减少排放物和/或废料进入环境而经常采取的步骤包括排放前对废 水进行处理(过滤、沉淀池),提高饲料效率和消化性,对敏感区域的产量实行限制以及采用循环水产养殖系统进行亲鱼维护、幼体饲养和/或养成活动
陆基生产活动的排放物和来自开放性水产养殖系统的剩余饲料/废物都会不利地影响周边环境。为减少排放物和/或废料进入环境而经常采取的步骤包括排放前对废 水进行处理(过滤、沉淀池),提高饲料效率和消化性,对敏感区域的产量实行限制以及采用循环水产养殖系统进行亲鱼维护、幼体饲养和/或养成活动
负责任水产养殖实践
红拟石首鱼的养殖应当遵守粮农组织《负责任渔业行为守则》中规定的原则。其规范包括维护遗传多样性,监测鱼类健康,预防疾病扩散,确保产品的高营养价值和限制品种养殖期间对环境造成的影响。
参考文献
书目
| Arnold, C.R. 1988. Controlled year-round spawning of red drum Sciaenops ocellatus in captivity. Contributions in Marine Science, 30:65-70. |
| Arnold, C.R., Bailey, W.H., Williams, T.D., Johnson, A. & Lasswell, J.L. 1976. Laboratory spawning and larval rearing of red drum and southern flounder. Proceedings of the Annual Conference of the Southeastern Association of Fish and Wildlife Agencies, 31:437-440. |
| Colorni, A., Diamant, A., Eldar, A., Kvitt, H. & Zlotkin, A. 2002. Streptococcus iniae infections in Red Sea cage-culture and wild fishes. Diseases of Aquatic Organisms, 49: 165-170. |
| Colura, R.L. 1990. Saltwater pond fertilization. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 78-79. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. |
| Craig, S.R., Arnold, C.R. & Holt, G.J. 1994. The effects of enriching live foods with highly unsaturated fatty acids on the growth and fatty acid composition of larval red drum Sciaenops ocellatus. Journal of the World Aquaculture Society, 25:424-431. |
| Crocker, P.A., Arnold, C.R., DeBoer, J.A. & Holt, G.J. 1981. Preliminary evaluation of survival and growth of juvenile red drum (Sciaenops ocellata) in fresh and salt water. Journal of the World Mariculture Society, 12:122-134. |
| Gatlin, D.M, III. 2002. Red drum, Sciaenops ocellatus. In: C.D. Webster & C.E. Lim (eds.), Nutrient Requirements and Feeding of Finfish for Aquaculture, pp. 147-158. CABI Publishing, New York, N.Y., United States of America. |
| Gaylord, T.G. & Gatlin, D.M. III. 1996. Determination of digestibility coefficients of various feedstuffs for red drum (Sciaenops ocellatus). Aquaculture, 139:303-314. |
| Hoese, D.H. & Moore, R.H. 1977. Fishes of the Gulf of Mexico Texas, Louisiana, and adjacent waters. Texas A&M University Press, College Station, Texas, United States of America. 327 pp. |
| Holt, G.J. 1993. Feeding larval red drum on microparticulate diets in a closed recirculating water system. Journal of the World Aquaculture Society, 24: 225-230. |
| Holt, G.J. 1990. Growth and development of red drum eggs and larvae. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 46-50. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. |
| Holt, J., Arnold, C.R. & Riley, C.M. 1990. Intensive culture of larval and post larval red drum. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 53-56. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. |
| Holt, J., Godbout, R. & Arnold, C.R. 1981a. Effects of temperature and salinity on egg hatching and larval survival of red drum, Sciaenops ocellata. Fishery Bulletin,79: 569-573. |
| Holt, J., Johnson, A.G., Arnold, C.R., Fable, W.A. & Williams, T.D. 1981b. Description of eggs and larvae of laboratory reared red drum Sciaenops ocellata. Copeia, 4:751-756. |
| Holt, S.A., Kitting, C.L. & Arnold, C.R.1983. Distribution of young red drums among different sea-grass meadows. Transactions of the American Fisheries Society, 112:267-271. |
| Hong, W. & Zhang, Q. 2003. Review of captive bred species and fry production of marine fish in China. Aquaculture, 227:305-318. |
| Lazo, J.P., Dinis, M.T., Holt, G.J., Faulk, C. & Arnold, C.R. 2000. Co-feeding microparticulate diets with algae: toward eliminating the need of zooplankton at first feeding in larval red drum (Sciaenops ocellatus). Aquaculture, 188:339-351. |
| Lutz, G. 1999. Red Drum: a re-emerging aquaculture species. Aquaculture Magazine, 25(4):38-41. |
| Matlock, G.C. 1990. The life history of red drum. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 1-21. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. |
| McBryde, G. 1994. Financial characteristics of a red drum aquaculture firm with winter nursery production. Aquaculture, 122:107-118. |
| McCarty, C.E., Geiger, J.G., Strumer, L., Gregg, B.A. & Rutledge, W.P. 1986. Marine fish culture in Texas: a model for the future. In: R.H. Stroud (ed.), Fish Culture in Fisheries Management, pp. 249-262. American Fisheries Society, Fish Culture and Fisheries Management Sections, Bethesda, Maryland, United States of America. |
| Neill, W.H. 1990. Environmental requirements of red drum. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 105-108. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. |
| O'Bryen, P.J. & Lee, C.-S. 2003. Management of aquaculture effluents workshop discussion summary. Aquaculture, 226:227-242. |
| Peters, K.M. & McMichael Jr., R.H. 1987. Early life history of the red drum, Sciaenops ocellatus (Pisces: Sciaenidae). Estuaries, 10:92-107. |
| Piedrahita, R.H. 2003. Reducing the potential environmental impact of tank aquaculture effluents through intensification and recirculation. Aquaculture, 226:35-44. |
| Roberts, D.E. Jr. 1990. Photoperiod/temperature control in the commercial production of red drum (Sciaenops ocellatus) eggs. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 35-43. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. |
| Simmons, E.G. & Breuer, J.P. 1962. A study of redfish Sciaenops ocellata Linnaeus, and black drum Pogonias cromis Linnaeus. Publications Institute Marine Science, University of Texas at Austin, 8:184-211. |
| Tacon, A.G.J. & Forster, I.P. 2003. Aquafeeds and the environment: policy implications. Aquaculture, 226:181-189. |

