| FAO Fisheries Synopsis No.107 | FRm/S107 SAST - Shrimp |
preparada por
NIBALDO BAHAMONDE
Museo Nacional de Historia Natural
Universidad de Chile (C.I.Z.)
Santiago, Chile
y
GABRIEL HENRIQUEZ
Instituto de Fomento Pesquero
Santiago, Chile
Heterocarpus reedi Bahamonde 1955, Investnes zool.chil., 2: 105–114, 1 cuadro, 2 gráficos, 4 láminas.
No tiene
Supragenérica
Phylum Arthropoda
Clase Crustacea
Subclase Malacostraca
Serie Eumalacostraca
Superorden Eucarida
Orden Decapoda
Suborden Natantia
Sección Caridea (Eucyphidea)
Superfamilia Pandaloida*
Familia Pandalidae*
Genérica
Heterocarpus A. Milne Edwards, 1881 Annls. Sci.nat.(Zool.), (6) 11 (4):8. Especie tipo por designación original H. ensifer A. Milne Edwards, 1881.
Según Holthuis (1955) deben considerarse sinónimos:
Procletes Bate 1888, Rep.scient.Res.Challenger, (Zool.) 24:883. Especie tipo por selección de Holthuis (1955) P. biangulatus Bate 1888:884.
Atlantocaris Ortmann, 1893. Plankton-Exped. 2 (Gb):80. Especie tipo por selección de Holthuis (1955) A. gigas Ortmann, 1893. Ergebn. Plankton-Exped. 2 (Gb):80 (= Heterocarpus ensifer A. Milne Edwards, 1881).
Definición
Caparazón rígido, con carena longitudinal post-rostral que se extiende generalmente hasta el margen posterior y con quillas laterales más o menos bien desarrolladas. Rostro armado con dientes fijos en la parte superior e inferior. Sin ocelos detrás de la cornea. Procesos laterales de la antena agudoe. Lóbulos posteriores del segundo maxilípodo redondeados. Segundo par de patas desiguales en longitud y con el carpo multiartioulado (Barnard, 1950).
Heterocarpus ensifer A. Milne Edwards (1881) sirvió para establecer el género.
Específica
Ejemplares tipos
Sintipos: en el Museo Nacional de Historia Natural de Chile (Santiago) D - 1213, 1214, 1215.
Lectotipo: D - 10575
Localidad típica
Entre Valparaíso y San Antonio a una profundidad aproximada de 319 m.
Diagnosis
Caparazón cefalotorácico atravesado por dos pares de carenas laterales longitudinales muy bien definidas, una lateral superior y otra lateral inferior. Existe además una carena dorsal superior que se continúa en el rostro. Rostro con 8–15 dientes dorsales y 6 a 13 ventrales. Abdomen con el 3°, 4° y 5° somitos carenados. Esta carena se prolonga posteriormente en un diente agudo. En el 3° somito abdominal existen además otros dos dientes, uno, el más pequeño, situado sobre el extremo proximal y el otro equidistante entre los dos ya señalados. Tercer maxilípodo sin exopodio. Telson terminado en punta y con tres espinitas dispuestas simétricamente, una de las cuales es terminal.
Semeja a H. hostilis Faxon (1893), pero difiere por la ausencia de exopodio en el tercer maxilípodo, por la presencia de dentículo en el margen anterior de la cresta dorsal del 3° segmento abdominal y por el número de dientes rostrales 7 a 8 en hostilis, 8 a 15 en reedi. En H. hostilis hay un solo diente detrás de la base del rostro, mientras en H. reedi hay 2 o 3.
Esta es una morfoespecie, la única conocida para el Pacífico sudoriental.
Chile: camarón nailon. Los pescadores y comerciantes lo designan también como “camarón de profundidad” o “gamba”.
Caparazón: Caparazón cefalotorácico, atravesado longitudinalmente por cinco carenas muy bien definidas, de las cuales la central se prolonga anteriormente para formar un rostro que tiene casi la misma longitud que la porción restante del cefalotórax (Fig. 1). Este rostro está provisto de 8 a 15 dientes dorsales, siendo los proximales de mayor tamaño que los distales; el posterior está situado casi en el límite entre la región gástrica y la cardíaca. El margen ventral del rostro está provisto de 6 a 13 dientes (sin embargo, en un ejemplar contamos 20) muy fuertes, el posterior situado considerablemente delante del margen orbital.
La segunda carena, carena lateral superior o postorbital, es par, comienza justamente sobre el diente orbital y se dirige hacia afuera y hacia abajo a lo largo de la superficie del cefalotórax, convergiendo suavemente hacia la carena media desde su mitad posterior y hacia el extremo posterior. A corta distancia del margen caudal del cefalotórax esta carena se curva en ángulo recto hacia la carena media, detrás de la cual se junta con la porción correspondiente de la carena lateral del lado opuesto.
La tercera carena, carena lateral inferior o postantenal, también par, comienza en el ángulo fronto-lateral del caparazón y se proyecta hacia adelante en un fuerte diente. Hacia atrás sigue paralelamente a la carena postorbital. Termina gradualmente, perdiéndose a corta distancia del margen posterior del cefalotórax.
El margen infero-lateral del caparazón cefalotorácico está atravesado también por un fuerte solevantamiento, que no alcanza a tener la notoriedad de las carenas anteriormente señaladas, el cual comienza sobre el lado interno del diente fronto-lateral y siguiendo la línea del margen lateral continúa hasta el borde posterior.
El cefalotórax está cubierto de escamas situadas de preferencia en las zonas que quedan entre las carenas.
Abdomen: Abdomen recubierto por escamas pequeñas. Sus dos segmentos anteriores son totalmente lisos, pero en el margen superior del tercer segmento abdominal aparece abruptamente una carena que se continúa sobre el 4° y 5° somito abdominal. En cada uno de éstos la carena se prolonga distalmente en un diente agudo. Además de éste en el tercer segmento aparecen otros dos, uno más pequeño sobre el extremo proximal de la carena y otro equidistante entre los dos recién señalados. Las pleuras de los tres primeros segmentos son redondeadas, mientras que las de los segmentos 4° y 5° terminan posteriormente en un ángulo agudo. No se observa ningún otro tipo de espina en los segmentos. El 6° segmento abdominal tiene casi el doble de longitud del 5°.
Telson: es casi igual a la suma del largo de los 5° y 6° segmentos y se adelgaza paulatinamente. Posee una parte central superior acanalada y los ángulos laterales provistos de dos espinas a cada lado.
Es ligeramente más largo que los urópodos y termina distalmente en tres espinas, siendo la central la más corta, casi la mitad del largo de las otras dos.
Pereiópodos: el primer par es casi del mismo tamaño y de la misma forma que el tercer maxilípodo, aunque ligeramente más delgado, diferiendo de éste por las proporciones de los diversos segmentos que lo constituyen.
El segundo par está formado por dos apéndices desiguales, provistos de pequeñas quelas terminales. El del lado izquierdo es de mayor tamaño y tiene el carpo y el meropodito anillados, mientras que en el derecho estas anillaciones se observan sólo en el carpo.
Los tres pares posteriores son semejantes en longitud y en forma. Poseen un meropodito sumamente desarrollado, cuya longitud es equivalente a la del isquiopodito, propodito y dactilopodito sumados. Su margen posterior está provisto de una serie de dientes fuertes y comprimidos, como espinas. La articulación entre el dactilopodito y el propodito está franjeada de abundante pilosidad.
Pleópodos: en la hembra tienen un pedúnculo algo aplanado que lleva dos largas ramas subiguales en longitud, foliáceas y provistas de pelos largos y abundantes. El primer par hace, sin embargo, excepción a los que le continúan, ya que la rama interna y anterior es más corta que las otras y presenta en su extremidad distal una prolongación flageliforme.
El 6° par de pleópodos, que es el terminal y forma las placas laterales del rhipidura o abanico caudal, está reforzado hacia el margen externo de la rama interna por un engrosamiento longitudinal que va desde la base de esta rama a su porción distal en el límite con la diéresis. La diéresis es muy notable y la porción que está delante de ella es más ancha que la porción posterior.
Las ecuaciones siguientes expresan la relación longitud cefalotorácica/longitud total:
y = 22,94 + 0,298 x
longitud abdomen/longitud total
y = 10,5 + 0,592 x
siendo x, en ambas ecuaciones, la longitud total en mm.

Fig. 1 A, Heterocarpus reedi Bahamonde, 1955 (tamaño natural). B, primer pleópodo de la hembra. C, primer pleópodo del macho.
El área de dispersión conocida es muy limitada. Se extiende frente a la costa chilena entre Taltal (25°19'L.S.) y Puerto Saavedra (39°00 'L.S.) a profundidades variables entre 155 y 424 m, con fondos de arcilla, roca sedimentaria (laja), arena fangosa y fango.
Vive bajo el límite de las aguas antárticas intermedias, inmediatamente debajo de las aguas subtropicales. Las aguas antárticas intermedias se caracterizan, según Brandhorst (1963), por su baja salinidad y su contenido de oxígeno relativamente alto, mientras las aguas de origen subtropical que son arrastradas hacia el sur por la Corriente de Günther tienen salinidad más alta, variable entre 34,6 y 34,9 ‰ con un contenido de oxígeno muy bajo.
H. reedi es heterosexual. Machos y hembras pueden diferenciarse por la situación del poro genital. En los machos éste se encuentra en el 5° par de pereiópodos, mientras en las hembras está en el 3°. La morfología del primer par de pleópodos abdominales es también un buen carácter para determinar el sexo. En las hembras el endopodito es angosto y termina en una punta aguda, siendo ancho en los machos y desprovisto de ésta (Fig. 1 B y C). El Dr. J.A. Allen, Dove Marine Laboratory, Inglaterra (com. per.) en base a observaciones de cortes de gónadas considera que la especie presenta sexos separados y no habría por el momento evidencia de reversión sexual.
El tamaño mínimo de los ejemplares ovíferos es de 19,5 mm de longitud cefalotorácica. Aparentemente en los individuos que habitan hacia el sur del área de dispersión esta longitud es mayor, lo cual probablemente está relacionado con la temperatura ambiental.
El número de huevos puestos por hembra varía según la talla; los ejemplares de 25 mm tienen un promedio de 1.700, mientras los de 35 mm tienen uno de 3.320. La curva de fecundidad aparece en la Fig. 2 (Bahamonde, 1958).
La estación de puesta se extiende durante casi todo el año, excepto en los meses de verano. Aparentemente se adelanta hacia el norte del área de dispersión atrasándose hacia el sur, como puede apreciarse en la Fig. 3, donde se han graficado los datos correspondientes a la pesca comercial (PC) y a las prospecciones realizadas al sur del área en que tradicionalmente se pesca. El máximo de puesta ocurre entre junio y octubre, declinando en los meses siguientes (Mistakidis y Henríquez, 1966; Hancock y Henríquez, 1968 e información no publicada).
El período de desove no se repite con exactitud de un año a otro, como puede comprobarse en la figura citada.
H. reedi ha sido encontrado en el contenido gástrico de merluzas (Merluccius gayi gayi) capturadas entre septiembre de 1965 y noviembre de 1966 en el área de Valparaíso (Hoyl, MS), y también frente a Coquimbo, junio de 1967, y en el área de Talcahuano, octubre-noviembre del mismo año (S. Avilés, com.per.).
El contenido gástrico presenta detritus y restos de crustáceos, entre ellos numerosas escamas de la cutícula de H. reedi, posibles setas de poliquetos y fango.
Es muy probable que esta especie presente migraciones verticales y horizontales en ciertos períodos del año, fenómeno que es usual entre los camarones Caridea y Peneidea.
Observaciones esporádicas realizadas a bordo de arrastreros muestran menores capturas durante la noche, lo que sugeriría que los camarones no se encontraban en el fondo. Hay también indicaciones de migraciones horizontales al aproximarse el invierno (Mistakidis y Henríquez, 1966).

Fig. 2 Relación entre el número de huevos y longitud del cefalotorax.

Fig. 3 Porcentaje de machos y frecuencia de hembras ovíferas en pescas comerciales y prospecciones.
El porcentaje de machos y de hembras en la población total es muy variable a lo largo del año, siendo siempre el porcentaje de machos inferior al 50 por ciento. Porcentajes altos de machos han sido observados entre septiembre de 1965 y febrero de 1966 y bajos en los meses de agosto a julio de 1965, no repitiéndose con exactitud las observaciones entre un año y otro (Fig. 3).
Aun dentro de las mismas áreas de pesca los porcentajes son distintos, como se observa en el cuadro siguiente:
| Area de muestreo | Fecha 1965 | Número de observaciones | Porcentaje de hembras |
| A:Constitución Lat:34°55'–35°50'S | Oct. 15–17 | 4 | 55,8–82,1 |
| B:Talcahuano Lat:35°55'–36°50'S | Oct. 18–22 Nov. 17–23 | 9 | 33,8–94,2 |
| C:Arauco Lat:36°55'–37°55'S | Nov. 12–15 | 3 | 56,7–70,6 |
| D:Isla Mocha Lat:38°00'–39°00'S | Oct. 27 Nov. 7 | 3 | 28,8–85,3 |
| (Mistakidis y Henríquez, 1966) | |||
Existen datos recolectados para 1966 por el Instituto de Fomento Pesquero de las capturas realizadas en Coquimbo, Quintero, Valparaíso y San Antonio. Los ejemplares capturados en Valparaíso y San Antonio presentan tallas mayores que los capturados más al norte, en Coquimbo (Fig. 4).
Con respecto a la distribución por tamaño las pescas exploratorias muestran que, en general, los machos son más pequeños que las hembras. El rango observado fue de 13 a 34 mm de longitud promedio para machos y de 23,0 a 28,2 mm y 21,8 a 30,0 mm para hembras (Mistakidis y Henríquez, 1966).
Los resultados preliminares sugieren que no hay diferencias significativas en la relación talla/peso de ejemplares machos y hembras no ovíferas. Las hambras ovíferas presentan, en cambio, un peso mayor (Hancock y Henríquez, 1968).
Los puertos más importantes son Coquimbo, Quintero, Valparaíso y San Antonio, descargándose en Valparaíso más del 50 por ciento del total desembarcado en Chile, que en 1966 alcanzó 10.911 t. Las mejores áreas de captura están entre los 29° y 35°L.S. En estas áreas los barcos pueden esperar capturas superiores a los 1600 kg por hora de arrastre. Exploraciones recientes permiten ampliar el área hasta los 37°L.S. Hacia el extremo norte del país no se han encontrado densidades comerciales, como lo demostró una corta exploración hecha frente a Taltal (25°L.S.), donde se capturaron escasos ejemplares (Hancock y Henríquez, 1968).
Observaciones sobre la abundancia de esta especie, realizadas en octubre - noviembre de 1965, noviembre de 1966 y noviembre de 1967, permiten establecer que los rendimientos por hora de arrastre en el área 35° – 37°L.S. son relativamente constantes para la misma época, cambiando durante el año de un período a otro, como lo demuestra el hecho que las capturas en esta área fueron en marzo de 1966 alrededor de la mitad de las obtenidas en octubre - noviembre (Mistakidis y Henríquez, 1966; Hancock y Henríquez, 1968 e información no publicada).
Al calcular, según el método de Karlovac (1953), el porcentaje con que cada talla contribuye anualmente al incremento de la población se obtiene el siguiente cuadro:
| Grupos por tamaño, mm | % relativo de jóvenes | |
| Coquimbo | Valparaíso | |
| 20 | 0,1 | - |
| 21 | 0,1 | - |
| 22 | 0,5 | - |
| 23 | 1,4 | 0,3 |
| 24 | 3,3 | 1,2 |
| 25 | 5,3 | 3,6 |
| 26 | 9,3 | 5,8 |
| 27 | 12,2 | 8,7 |
| 28 | 14,9 | 11,3 |
| 29 | 12,4 | 15,0 |
| 30 | 14,6 | 14,2 |
| 31 | 10,3 | 12,1 |
| 32 | 7,5 | 10,1 |
| 33 | 4,0 | 6,3 |
| 34 | 1,7 | 7,0 |
| 35 | 2,0 | 2,9 |
| 36 | 0,1 | 0,9 |
| 37 | 0,1 | 0,1 |
| 38 | - | 0,2 |
| 39 | - | 0,2 |
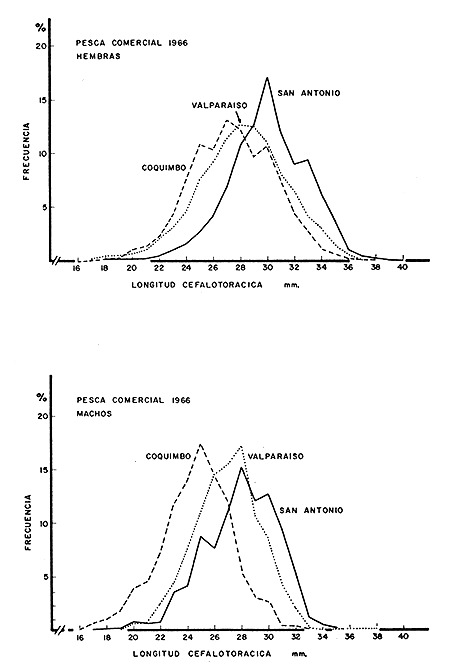
Fig. 4 Distribución por tallas para machos y hembras en la pesca comercial en Valparaíso, Coquimbo y San Antonio (1966).
Los correspondientes porcentajes acumulativos aparecen en la Fig. 5. El 50 por ciento de los jóvenes está dado por individuos hembras con tallas inferiores a los 28,0 mm en el caso de Coquimbo y de 29,0 mm en el caso obtenido en Valparaíso. La diferencia puede ser consecuencia de la talla mínima de desove, que es menor para Coquimbo que para Valparaíso.
Las capturas de camarones son acompañadas por merluza (Merluccius gayi gayi), besugo (Epigonus (Xystramia) crassicaudus), congrio negro (Genypterus maculatus), lenguado (Paralichthys sp.), raya (Raja sp.), cabrilla (Sebastodes sp.) y pejerata (Coelorynchus chilensis) entre los peces, y por gambas (Hymenopenaeus diomedeae), langostino amarillo (Cervimunida johni), langostino colorado (Pleuroncodes monodon), panchote colorado (Libidoclaea granaria smithii), jaiba limón (Cancer porteri) y jaiba paco (Mursia gaudichaudi) entre los crustáceos. Es imposible decidir por el momento si estas especies conviven con Heterocarpus reedi, ya que la red de arrastre captura especies a diversas profundidades.

Fig. 5 Porcentajes acumulativos de tallas de hembras ovíferas de camarón nailon en Valparaíso y Coquimbo.
Arrastre: el modelo en general corresponde a redes camaroneras de arrastre con portalones (Fig. 6). El material de hilo usado es nilón o polietileno multifilamentoso. Las redes poseen embande en la línea lateral de un 12 a un 20 por ciento y en el borlón de un 8 a un 18 por ciento.
La medida de la malla fluctúa entre 35 y 40 mm, variando el grosor del hilo en las diferentes partes de la red.
Portalones. Se emplean de fierro o de fierro con madera y su peso es proporcional a los H. P. efectivos de motor; por ejemplo a 350 H.P. de la embarcación corresponden portalones de 350 kg de peso cada uno.
La flota dedicada a la captura de camarón nailon es muy heterogénea. Está compuesta por cuarenta barcos, cuyo tonelaje varía entre 40 y 280 T.R.B. El casco es de acero o madera, con motor Diesel o a vapor (120 a 1.300 H.P.).
Características de los barcos
| Tamaño de la eslora en m | Tipo de casco y motor | ||
| Acero | Madera | ||
| Diesel | Vapor | Diesel | |
| De 16 a 20 | 5 | - | 3 |
| De 20 a 25 | 18 | - | 6 |
| De 25 a 30 | 3 | - | - |
| Más de 30 | 1 | 4 | - |
El área de captura se extiende desde el norte de Coquimbo (23° 30'L.S.) hasta un poco más al sur de Constitución (35°40'L.S.), en el borde de la estrecha plataforma continental de la costa chilena (Fig. 7). Los puertos de desembarque más importantes son: Conquimbo, Quintero, Valparaíso y San Antonio, siendo el principal Valparaíso.
Se captura en el área antes señalada, que ocupa una extensión de norte a sur de más de 300 millas naúticas (555 km) y un ancho de 30 millas (55 km) desde la costa.
CUADRO I
Dimensiones e incidencia de los diseños básicos de las redes empleadas en la pesquería (en m) (Henríquez, MS)
| Trawl alemán | Red de dos puntas | Trawl corto sin cielo | ||
| Alas rectas | Alas diagonales | |||
| Borlón superior | 22,00 | 20,40 | 23,80 | 18,20 |
| Borlón inferior | 27,40 | 23,30 | 23,80 | 18,20 |
| Línea lateral | 22,00 | 15,40 | 16,80 | 15,60 |
| Porcentaje de incidencia en la pesquería | 78 | 8 | 14 | |
Las embarcaciones están equipadas con radioteléfono y ecosondas aptos para detectar sólo profundidades y fondos adecuados para la pesca. No se usan para ubicar cardúmenes, (Henríquez, MS).

Fig. 6 Esquemas básicos de los sistemas de trawl para camarones y langostinos en Chile.

Fig. 7 Areas de pesca
La pesca se realiza sobre fondo de fango y roca sedimentaria (laja).
Se pesca durante todo el año, pero las mayo res capturas se logran de septiembre a diciembre y las menores, en los meses de invierno, o sea, julio y agosto, debido al mal tiempo.
Los desembarques de camarón nailon se iniciaron en 1957 con 129 t, incrementando rápidamente hasta sobrepasar las 10.000 t en 1966, paralelamente con el aumento del potencial pesquero. Es diffcil obtener medidas satisfactorias del esfuerzo. Un estudio detallado del problema ha sido hecho por Hancock y Henríquez (1968) y Saetersdal, Henríquez y Sanhueza (MS).
Las capturas por hora de arrastre son variables. El Cuadro II muestra algunos rendimientos obtenidos en pescas comerciales y exploratorias (Mistakidis y Henríquez, 1966 e información no publicada).
No hay estudios especiales sobre selectividad. El tamaño mínimo de los ejemplares capturados es de 15 mm de longitud cefalotorácica y el máximo, de 39 mm.
De acuerdo con las estadísticas del Departamento de Pesca y Caza del Ministerio de Agricultura y del Instituto de Fomento Pesquero de Chile la producción total de camarones en el período 1960–66 se describe en el Cuadro III.
CUADRO II
| Fecha | Número de lances observados | Area de pesca L.S. | Captura estimada kg/h arrastre Min. - Max. | Captura promedio kg/h arrastre | Profund. m Min. - Max. | Profund. promedio m | |
| Mar. | 1965 | 11 | 34°08'–34°26' | 260 – 1560 | 910 | 340 – 380 | 360 |
| Oct.-Nov. | 1965 | 13 | 34°55'–35°50' | 250 – 1230 | 582 | 155 – 295 | 225 |
| Oct.-Nov. | 1965 | 30 | 35°55'–37°55' | 80 – 1735 | 514 | 170 – 365 | 268 |
| Oct.-Nov. | 1965 | 19 | 36°55'–37°55' | 6 | - | 220 – 340 | 280 |
| Oct.-Nov. | 1965 | 14 | 38°00'–39°00' | 64 | - | 170 – 225 | 198 |
| Mar.-Abr. | 1966 | 5 | 34°55'–35°50' | 130 – 676 | 403 | 180 – 310 | 245 |
| Mar.-Abr. | 1966 | 12 | 35°55'–36°50' | 54 – 450 | 252 | 180 – 286 | 233 |
| Mar.-Abr. | 1966 | 4 | 38°00'–39°00' | 4 | - | 209 – 216 | 213 |
| Nov. | 1966 | 3 | 34°55'–35°50' | 5 | - | 252 – 360 | 306 |
| Nov. | 1966 | 18 | 36°50'- | 23 – 1791 | 907 | 216 – 257 | 237 |
CUADRO III
Producción de camarón nailon entre 1960 y 1966 (en t)
| Años | Coquimbo | Quintero | Valparaíso | San Antonio | TOTALES |
| 1960 | - | - | 2615,1 | 17,8 | 2632,9 |
| 1961 | 115,1 | - | 2214,0 | 24,0 | 2353,1 |
| 1962 | 332,1 | - | 3981,0 | 33,0 | 4346,1 |
| 1963 | 314,0 | 251,0 | 2989,0 | 79,6 | 3634,0 |
| 1964 | 727,7 | 463,1 | 4683,0 | 73,1 | 5947,0 |
| 1965 | 816,0* | 786,6* | 2962,0* | 451,0* | 5015,6* |
| 1966 | 901,0* | 1417,0* | 5710,0* | 2943,0* | 10911,0* |
* Datos del Instituto de Fomento Pesquero
Exists veda para los camarones de mar, no consignándose la especie, entre el 1° de septiembre y el 31 de diciembre, desde Punta Lilenes (Quintero) a Punta Lobos (Quintay) por Decreto 455, del 20 de febrero de 1940, del Ministerio de Economía y Comercio. Además hay veda indefinida para la captura de hembras con huevos visibles, según el Decreto con Fuerza de Ley No 1584, del 30 de abril de 1934.
Se prohibe también la captura de camarones de talla inferior a 2,5 cm de acuerdo con el Decreto No 2300, del 26 de noviembre de 1935. El tamaño se mide entre la base de las antenas y el borde posterior del caparazón.
Bahamonda, N., 1955 Hallazgo de una especie nueva de Heterocarpus en aguas chilenas: H. reedi n. sp. Investnes zool.chil., 2:105–14
Bahamonda, N., 1958 Sobre la fecundidad de la gamba o camarón nailon (Heterocarpus reedi Bahamonde). Investnes zool.chil., 2:259–64
Bahamonde, N. y M.T. López, 1960 Observaciones sobre la época de desove de la gamba (Heterocarpus reedi Bahamonde). Rev.Univ.Santiago, 44(5):39–41
Barnard, K.H., 1950 Descriptive Catalogue of South African decapod Crustacea. Ann.S.Afr.Mus., 38:1–837
Brandhorst, W., 1963 Descripción de las condiciones oceanográficas en las aguas costeras entre Valparaíso y el Golfo de Arauco, con especial referencia al contenido de exígeno y su replación con la pesca. Ministerio de Agricultura, Santiago, Chile, 55 págs., 26 figs.
Faxon, W., 1893 Reports on the dredging operations off the west coast of Central America to Galapagos, to the west coast of Mexico, and in the Gulf of California, in charge of Alexander Agazziz, carried on by the U.S. Fish Commission ALBATROSS during 1891. 6. Preliminary descriptions of new species of Crustacea. Bull.Mus.comp.Zool.,Harv., 24(Art.7):149–220
Hancock, D.A. and G. Henríquez, 1968 Stock assessment in the shrimp (Heterocarpus reedi) fishery of Chile. FAO Fish.Rep., (57)Vol.2:443–65
Henríquez, G., MS Artes y métodos de pesca de camarones y langostinos en Chile.
Holthuis, L.B., 1955 The recent genera of the caridean and stenopodidean shrimps (Crustacea, Decapoda, Natantia) with keys for their determination. Zool.Verh.Leiden, 26:1–157
Hoyl, A., MS Alimentación de la merluza (Merluccius gayi gayi) en la zona de Valparaíso (Chile).
Karlovac, O., 1953 An ecological study of Nephrops norvegicus (L) of the High Adriatic. Izvjirib.-biol.Eksped. “HVAR”, 5(2C):1–50
Mistakidis, M.N. Y G. Henríquez, 1966 Informe sobre investigaciones exploratorias de langostinos y camarones en la zona de Constitución - Isla Mocha, octubre - noviembre 1965. Publnes Inst.Fom.pesq., (16):1–18
Saetersdal, G., G. Henríquez and A. Sanhueza, MS A preliminary analysis of statistics of catch and effort of the shrimp and langostino fishery, 1960–65, and a comparison of the size of landed shrimp, 1958–59 and 1965–66. Santiago, IFOP (Unpubl.rep.)
Thompson, J.R., 1966 Comments on phylogeny of section Caridea (Decapoda Natantia) and the phylogenetic importance of the Oplophoroidea. Symp.ser.mar.biol.Ass.India, (2):314–26
