Ce chapitre a pour objet d'aider les récolteurs à comprendre la biologie de la reproduction des acacias afin de permettre une programmation et une exécution efficaces des opérations de récolte de semences. A cet effet, des indications détaillées sont données sur les processus qui interviennent lors du développement des graines, tels que développement et sexualité des fleurs, pollinisation, système de reproduction, hybridation, et développement de la graine et du fruit, ainsi que sur la phénologie de la floraison et de la fructification, le rendement en semences, et les parasites de la gousse et de la graine.
Lorsque les conditions sont favorables, la plupart des acacias produisent des fleurs à profusion. La Fig. 7 illustre le processus de développement de la fleur à la graine mûre.
Les différents stades du développement de la graine sont esquissés ci-dessous.
Des études détaillées de l'anatomie et de l'embryologie de la fleur ont été réalisées par Newman (1934) pour A. baileyana et par Buttrose et al. (1981) pour A. pycnantha. On dispose d'études détaillées de la structure et du développement du style et du stigmate de plusieurs acacias australiens (Kendrick et Knox 1981). On n'a accordé en revanche que peu d'attention à la séquence complète de développement floral chez les acacias. Buttrose et al. (1981) ont constaté que chez A. pycnantha les bourgeons floraux sont produits continuellement sur de nouvelles pousses durant chaque mois de l'année. En dépit de cette prolificité seuls les bourgeons produits entre novembre et mai se développent jusqu'au stade de floraison, tandis que ceux produits le reste de l'année (juin à octobre) avortent précocement. Chaque inflorescence d'A. pycnantha comprend de 40 à 100 fleurs.
 |  |
 |  |
 | 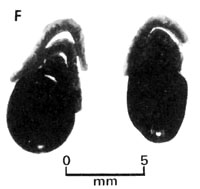 |
Fig. 7 - Séquence de floraison et fructification chez A. aneura
(A) Jeunes bourgeons floraux (B) Stade de la floraison
(C) Groupes de gousses et de phyllodes (D) Groupe de gousses
(E) Gousse ouverte avec graines (F) Graines isolées.
On n'a que peu d'observations sur l'âge minimum auquel les acacias peuvent produire des fleurs, mais il semble qu'il se situe entre un et quatre ans. A. mearnsii dans les reboisements d'Afrique du Sud commence à fleurir à l'âge de 20 mois environ, mais bien que fournissant des graines mûres à partir de la troisième année ce n'est qu'à la cinquième ou sixième année qu'il produit des quantités appréciables de semences (Sherry 1971).
La plupart des acacias ont des fleurs bisexuées (comportant des organes mâles et femelles sur la même fleur). De nombreuses espèces du Queensland, toutefois, présentent sur certains individus à la fois des fleurs staminées (mâles) et des fleurs bisexuées, phénomène observé également sur A. baileyana par Newton (1934) et sur A. nilotica par Sinha (1971). Certains épis ou capitules peuvent même ne comporter que des fleurs mâles, mais en général on y trouve au moins quelques fleurs bisexuées. Les conditions de milieu lors du développement floral peuvent déterminer la proportion de fleurs mâles. Il convient de noter que l'on trouve souvent un ovaire rudimentaire dans des fleurs qui sont fonctionnellement mâles, et que cet ovaire ne présente pas de pilosité, même chez les espèces où l'ovaire normalement développé est velu.
Les insectes sont les principaux agents pollinisateurs des acacias, tout au moins des espèces africaines (Coetzee 1955). Les abeilles sont les principaux pollinisateurs d'A. mearnsii en Afrique du Sud, le vent ne jouant tout au plus qu'un rôle très accessoire (Sherry 1971). Il est possible également que les oiseaux, attirés par les nectaires extra-floraux des acacias, interviennent dans la pollinisation (Ford et Forde 1976).
Le système de reproduction des acacias est semble-t-il l'allogamie préférentielle. Le taux d'allogamie naturelle chez A. mearnsii a été estimé entre 67 et 98 % (Moffett 1956; Sherry 1971). Les expériences de Moffett (1956) ont montré que le nombre de graines par gousse était sensiblement inférieur après autopollinisation, bien que la viabilité des semences produites fût peu différente de celle des semences issues d'allogamie.
L'accouplement d'individus proches parents, notamment dans les espèces qui se régénèrent facilement par voie végétative (ex. A. albida), et l'éloignement entre individus pour certaines espèces, comme c'est le cas d'A. albida et A. tortilis dans une partie de leur aire naturelle, pourraient contribuer à un degré élevé d'autopollinisation dans certaines populations.
La plupart des espèces d'acacias ont un nombre chromosomique 2n = 26 (Pedley 1978; Ross 1981), cependant des espèces du sous-genre Acacia ont 2n = 52 chromosomes (Ross 1979). Toutes les espèces du sous-genre Heterophyllum qui ont été étudiées ont 2n = 26 chromosomes, à l'exception de six d'entre elles, dont A. aneura qui a 2n = 52 chromosomes, et A. sowdenii qui en a 2n = 38 (Pedley 1978). Pour plus de détails le lecteur peut consulter Atchison (1948) et Guinet et Vassal (1978).
On sait qu'il se produit naturellement des hybrides interspecifiques, mais on ignore quel est le degré exact d'hybridation et d'introgression chez les acacias.
Le premier indice qui permet de penser qu'on a affaire à un hybride est généralement la présence de caractères morphologiques qui sont dans une certaine mesure intermédiaires entre ceux des deux espèces que l'on suppose être les parents. Elamin (1976) a montré que A. laeta a des caractères morphologiques intermédiaires entre ceux d'A. mellifera et d'A. senegal, et a confirmé la présomption de son origine hybride. Des sujets très vigoureux, intermédiaires entre A. auriculiformis et A. mangium, apparaissent occasionnellement dans les plantations d'A. mangium au Sabah (Malaisie)
Ali et Farugi (1969) et Ali et Qaiser (1980) attribuent la variabilité du complexe A. nilotica au Pakistan à une hybridation entre A. nilotica subsp. indica et A. nilotica subsp. hemispherica. Ces chercheurs ont constaté que les populations hybrides, favorisées par l'action de l'homme qui propage des semences et crée des habitats perturbés, peuvent se croiser en retour avec A. nilotica subsp. indica et A. nilotica subsp. hemispherica, donnant des sujets qui ressemblent à A. nilotica subsp. adstringens et A. nilotica subsp. subalata. On a également évoqué la probabilité d'une hybridation entre A. nilotica subsp. indica et A. nilotica subsp. cupressiformis.
Après la pollinisation, l'ovaire mûrit à l'intérieur de la fleur pour former la gousse caractéristique des légumineuses. Si l'on considère le nombre de fleurs produites, il n'y a que peu de gousses par inflorescence (2 ou 3 pour 1000). Chez les acacias les ovules sont fixés dans des alvéoles peu profonds le long de l'axe de la gousse en développement, et sont reliés à l'ovaire par le funicule. La gousse atteint sa taille définitive avant que les ovules se développent en graines. Elle est tout d'abord verte et charnue, mais avec le temps les fibres se lignifient et durcissent.
A maturité la gousse s'ouvre en général longitudinalement suivant les deux bords. Les graines peuvent ne pas tomber immédiatement; certaines peuvent rester attachées par le funicule jusqu'à ce que la gousse elle-même tombe.
Les graines d'acacias ont une taille, une forme et un poids extrêmement variables, et même dans une même espèce on peut constater des différences marquées (Cavanagh 1980 a). Le tégument des graines d'acacia est relativement épais en comparaison de celui de nombreuses légumineuses à petites graines; dans un cas étudié par Murray et al. (1978), il représentait 33–43 % de la masse totale de la graine. L'anatomie du tégument des graines d'acacias a fait l'objet d'une étude de synthèse par Cavanagh (1980 a), et on peut trouver dans gunn (1981) une description plus générale des graines de légumineuses.
Pedley (1978) indique que la majorité des espèces d'acacias du Queensland fleurissent en même temps chaque année (pendant souvent moins de six semaines) à la saison la plus sèche, de juin à septembre - quelles que scient les conditions climatiques qui précèdent la floraison. Il s'agit peut-être d'une réaction photopériodique. Chez de nombreuses espèces de la zone aride, toutefois, il semble que la floraison dépende de l'humidité disponible, et puisse se produire en toute saison (Mott 1979).
Davies (1976) rapporte des observations phénologiques de longue durée sur des arbustes pérennes, dont plusieurs acacias, dans une région aride d'Australie. Il a constaté que bien qu'A. aneura puisse fleurir après une pluie à n'importe quelle saison, seules les fleurs résultant de pluies d'été produisaient des fruits, et qu'il n'y avait production abondante de gousses mûres que si les pluies étaient suffisantes au cours de l'hiver suivant. Preece (1971 a) a étudié les effets de l'irrigation sur des sujets d'une population d'A. aneura, et bien que les résultats de ces essais ne soient pas concluants ils sont en accord avec ceux de Davies. Prenant comme critère le fait que des pluies d'été suivies de précipitations hivernales sont nécessaires pour la réussite de la reproduction, Preece analyse environ 80 années de données pluviométriques dans plusieurs stations, et constate que dans seulement 10–15 % des années considérées les conditions climatiques étaient favorables pour la production de semences. Le Tableau 1 présente un résumé des époques de floraison et de fructification d'A. aneura, et des données sur les graines.
La phénologie de la floraison et de la fructification d'A. albida, A. caven, A. nilotica et A. tortilis varie selon les espèces. Le Tableau 1 indique les époques observées par espèce et par pays, ainsi que certaines données sur les graines.
La production de semences des acacias peut s'exprimer de nombreuses manières, par exemple en nombre de graines par gousse, ou par arbre, ou par unité de surface. Le Tableau 1 indique le nombre de graine par gousse pour diverses espèces, ainsi A. albida en Afrique du Sud produit 14–21 graines par gousse, tandis qu'A. senegal au Pakistan en produit de 2 à 5.
Tableau 1. Epoque de floraison et de récolte des graines par espèce et par pays pour six acacias, et données sur la production et la germination des semences
| Espèce | Pays et référence | Mois de floraison | Mois de récolte des graines | Durée de la période de récolte | Périodicité des bonnes récoltes | Nombre de graines/ gousse | Nombre de graines/ kg | Germination (%) | Autres remarques |
| A. albida | Israël FAO 1980 | avril–juin | Production limitée | ||||||
Kenya FAO 1975 | 70–100 | ||||||||
Nigeria FAO 1974a, 1975 | 20 400 | 70–100 | |||||||
Sahel Maydell 1978 | Semences facilement disponibles | ||||||||
Sénégal Giffard 1964 | Environ 2 mois avant la fin des pluies | Les gousses tombent 3 mois après la floraison | 11 500 | Les graines ont une cuticule cireuse imperméable et conservent leur viabilité plusieurs années | |||||
Sénégal Giffard 1971 | mars–mai | 11 500 | |||||||
Afrique du Sud Carr 1976 | tout l'hiver | bonnes semences en quantité usuelle | 14–21 | jusqu'à 95 | |||||
Soudan Radwanski et Wickens 1967 | Début de la saison sèche | ||||||||
Soudan Wickens 1969 | 21 (basé sur 200 gousses) | Certains arbres ont produit 135 kg de gousses/an. 95% des gousses et des graines endommagées par les insectes. Jusqu'à 50% des graines détruites dans les gousses par des bruchidés. | |||||||
Zambie FAO 1975 | 40 000 | 0–30 | |||||||
Zimbabwe West 1950 | Début de la saison sèche | A partir d'août | |||||||
Références générales FAO 1974b | avril (Sénégal) | 11 000 | Les semences se conservent bien en l'absence d'insectes. | ||||||
| NAS 1979 | On a enregistré 125–135 kg de gousses sur un seul arbre. Des rendements de 400–600 kg de gousses/ha sont courants dans le Sahel. | ||||||||
| A. aneura | Australie/CSIRO (non publié) Davies 1968 Everist 1949 Preece 1971a Hall et al 1979 Burrows 1973 Winkworth 1973 | été/hiver seules les fleurs d'été produisent des fruits mûrs; abondance déterminée par les pluies d'hiver | oct.–nov. | oct.–mars (la plupart tombent précocement) | variable, dépend du régime pluviométrique; moins d'une sur 10 enregistrée | 50 000 – 100 000 | Des rendements de 2–11,45 kg de semences/ha ont été enregistrés. | ||
| A. caven | Argentine Anon. 1973 | à partir d'août | |||||||
Argentine H.R. Mangieri comm. pers. | oct.–nov. | fév.–mars | plusieurs semaines | variable, dépend des facteurs climatiques | |||||
Chili FAO 1975 | 10 000 | 30 – 70 | |||||||
Chili FAO 1980 | à partir de décembre mars | 10 000 | |||||||
Chili Instituto Forestal comm. pers. | 8 530 | 83 | |||||||
Amérique latine Flinta 1960 | 10 000 | Se régénère abondamment par semis naturels | |||||||
Références générales Goor et Barney 1976 | 10 000 | Les semences germent facilement | |||||||
| A. nilotica | Inde FAO 1980 | avril–juin | abondantes | 7 000–11 000 | |||||
Jamaïque Sinha 1973 | 8–16 | ||||||||
Afrique du Sud Carr 1976 | nov.–fév. déc. généralement | bonnes semences faciles à obtenir | jusqu'à 15 | 0–60 | |||||
Afrique du Sud Palmer et Pitman 1972 | octobre | mars–avril | 10–15 | ||||||
Soudan FAO 1980 | mars–juin | 8 000 (sous-espèce tomentosa) | |||||||
Soudan Khan 1970 | juillet–jan.(maximum en sept.–oct.) | janvier–mai (maximum en mars–avril) | La température influe sur la floraison et la fructification; la production de semences est sous la dépendance de l'évaporation. | ||||||
Références générales FAO 1974b NAS 1980 | 8 000 | Il peut y avoir des attaques sérieuses de bruchidés sur les graines dans les gousses. | |||||||
| A. senegal | Inde FAO 1980 | fév.–mars | 7 000 | ||||||
Nigéria FAO 1975 | 10 200 | 70–100 | |||||||
Pakistan FAO 1975 | 33 000 | 70–100 | |||||||
Pakistan Cheema et Qadir 1973 | août–déc. | à partir d'août | 2–5 | 16,7 à 82, 5% des graines détruites par les membracidés | |||||
Sahel Giffard 1975 | déc.–fév. | plusieurs semaines | 3–8 | 10 000–19 500 | Saupoudrer immédiatement les semences avec un insecticide | ||||
Afrique du Sud Ross 1968 | plusieurs mois, avec maximum au printemps-début été | Les bruchidés détruisent de grandes quantités de graines | |||||||
Afrique du Sud Carr 1976 | déc.–jan./avril | octobre | var.rostrata peut persister tout l'hiver | profuses | 1–6 | Semences indemnes en général facilement disponibles | |||
Soudan Sief el Din et Obeid 1971 | tous les 2–3 ans | 84% des graines détruites au sol avant la germination | |||||||
RDP Yémen FAO 1980 | oct.–nov. | ||||||||
Références générales FAO 1974b FAO 1980 | abondantes chaque année | – 7 000–8,000 | |||||||
| A. tortilis | France FAO 1975 | 16 100 | 30–100 | ||||||
Inde Pathak et al. 1980 | 45– 49 | On a noté une grande variabilité dans la réaction au traitement des graines | |||||||
Israël FAO 1980 | juin–juillet | graines abondantes | 50 000 | 40% des graines attaquées par des larves de bruchidés. Fumigation indispensable avant entreposage (“Phostoxin”). | |||||
| Israël Karschon 1975 | août | 50 | |||||||
Israël Karschon 1961 | juin–janvier | juillet | Les graines fraîches renferment 11–15% d'humidité. Les graines immatures de gousses vertes germent sans prétraitement. | ||||||
Kenya FAO 1975 | 30– 70 | ||||||||
Afrique du Sud Carr 1976 | jan.–fév. | jusqu'à 14 | Viabilité variable | ||||||
Soudan FAO 1980 | mars (sousespèce raddiana) avril–juillet (sous-espèce spirocarpa et tortilis) | ||||||||
RDP Yémen FAO 1980 | avril–mai | juin–juillet | |||||||
Références générales NAS 1980 | La production de semences est souvent fortement réduite par les insectes |
On n'a que peu de références sur le nombre de graines produites par plant, et aux différents âges. Monk et al. (1981) ont constaté pour A. pulchella (petit arbuste australien) que la production de graines commence à 2 ans, atteint un maximum de 12 000 graines par plant et par année à 3–4 ans, et décroît jusqu'à 2 000 graines par plant à la 13ème année. Un arbre adulte d'A. albida peut produire environ un demi-million de graines au Soudan, et en Afrique du Sud un sujet de grande taille, si la saison est favorable, peut en produire plusieurs millions (Wickens 1969).
Le nombre de graines produites par hectare est fonction de la densité, de l'âge et de la taille des arbres. On a indiqué des rendements de 2–12 kg (de l'ordre de 150 000 à 850 000 graines) de semences à l'hectare pour A. aneura (voir Burrwos 1973).
En dépit du fait que seule une très petite fraction des fleurs donne des fruits, la production potentielle de semences des nombreux acacias qui fleurissent à profusion est énorme. Réciproquement, le potentiel de destruction des semences est également très élevé. Ross (1979) a constaté que les insectes, le défaut de fécondation et autres facteurs étaient responsables de la perte de 50 % (43 415 graines) de la production potentielle d'un sujet d'A. caffra en Afrique du Sud. Palmer et Pitman (1972) donnent une liste de certains des nombreux insectes dont les larves se nourrissent aux dépens des boutons, des fleurs, des gousses et des graines d'acacias africains.
Les bruches (famille des Bruchidae) causent des ravages considérables dans les semences des acacias d'Afrique et d'Amérique Centrale. Selon la littérature, le pourcentage de semences détruites par les bruches est estimé entre 20 et 100% (le Tableau 1 donne quelques chiffres à ce sujet). Ross (1979) décrit la séquence d'attaque et le résultat final - normalement la bruche adulte pond ses oeufs à l'intérieur ou à la surface de la gousse verte au cours du printemps qui suit la chute des fleurs; les larves éclosent quelques semaines plus tard et pénètrent dans la jeune graine. Elles grossissent et se nymphosent à l'intérieur de la graine qui mûrit dans l'intervalle. Les insectes adultes sortent de la graine en découpant un trou rond à travers le tégument. Peu après leur sortie certains adultes peuvent pondre des oeufs qui fourniront la souche de nouvelles générations de bruches dans les graines sèches au cours des mois suivants. Les graines infestées par les bruches ne restent viables que si l'embryon est intact et que seulement une relativement faible partie des colylédons est mangée. Dans la petite fraction de graines infestées qui sont encore viables, les trous de sortie des insectes adultes facilitent grandement l'entrée de l'eau, ce qui perment une germination plus rapide.
En raison de la destruction d'une grande partie des semences sur l'arbre ou en dessous par les générations successives de bruches, une dispersion rapide des semences peut être d'une importance décisive pour la survie de certaines espèces d'acacias (Ross 1979). Certains acacias à gousses indéhiscentes (ex. A. albida, A. nilotica, A. tortilis) y sont parvenus grâce à leur adaptation à la dispersion de leurs semences par les grands mammifères, qui sont attirés par la forme, la taille et la valeur nutritive de leurs gousses. Par ce moyen les graines échappent en partie aux attaques des bruches, et grâce à leur tégument dur elles passent finalement relativement indemnes dans les excréments des animaux.
Tous les acacias ne sont pas affectés au même degré par les attaques de bruches, et certaines espèces semblent rebuter leurs larves. Les bruchidés ne sont pas des parasites importants des acacias en Australie, où leurs graines sont attaquées par d'autres insectes; c'est ainsi qu'un hyménoptère de la famille des chalcididés infeste A. aneura (Preece 1971 b).
Les oiseaux peuvent également causer des pertes importantes. Les fruits d'A. aneura sont fréquemment mangés par des perroquets avant d'avoir atteint leur pleine maturité, ce qui peut provoquer la perte de la totalité de la récolte de semences sur certains arbres (Davies 1976). Les fleurs et les fruits d'A. aneura sont également une source importante d'aliments pour les émeus. Divers autres oiseaux mangent aussi les graines d'acacias.