Rolando Quirós
Departamento de Aguas Continentales
Instituto Nacional de Investigación y Desarrollo Pesquero
Buenos Aires, Argentina
10.1 RESUMEN
Las introducciones de salmónidos en Argentina pueden considerarse como exitosas y han desarrollado poblaciones autosostenidas en lagos y embalses del sur y centro-oeste del país. A partir de información obtenida en un programa de muestreo extensivo en 112 lagos y embalses del país, se analizan los determinates ambientales de su distribución actual. Nuestra hipótesis de trabajo, sustentada por los registros de siembra de peces, postularía que la introducción de por lo menos una especie se intentó a lo menos una vez en todos los lagos y embalses de Argentina.
De las variables climáticas, morfométricas y edáficas analizadas, la temperatura media anual del aire (TEMP) es la que explica un mayor porcentaje de la variabilidad en la abundancia relativa de la familia Salmonidae (SALM). Los residuos de la regresión del SALM, versus TEMP, están relacionados negativamente con la abundancia relativa de especies de peces de las familias Atherinidae (ATER) y Percichthyidae (PERC). Estos resultados se mantienen cuando se analiza un subconjunto y se conjetura sobre la probabilidad de que en un ambiente dado se mantenga una composición equilibrada entre salmónidos, aterínidos y percíctidos.
La ordenación de los lagos y embalses por los componentes principales, y sobre la base de variables climáticas, morfométricas y edáficas, permite separar los ambientes en los cuales se desarrollaron poblaciones autosostenidas de salmónidos, de los ambientes en proceso de estabilización, de aquéllos en los cuales el desarrollo de poblaciones autosostenidas puede durar un período más o menos prolongado de tiempo, y de aquéllos en los cuales los stocks de salmónidos necesitan ser mantenidos por siembras sucesivas. Se discuten las ventajas de orden práctico que presenta el método comparativo de ordenación ambiental, con respecto a aquéllos de mayor contenido teórico pero sustentados por bases de datos mucho más limitados.
ABSTRACT
The introductions of salmonids in Argentina can be considered as successfull. They have become established as reproducing populations in southern and middle-western lakes and reservoirs. An extensive sampling programme on 112 lakes and reservoirs was carried out during the summers of 1984 to 1987. Environmental features that determine their present distribution were analyzed. The hypothesis, which we used as starting-point, is that it has been attempted to introduce at least once and least one species of salmonids in all lakes and reservoirs of Argentina.
Mean annual air temperature (TEMP) explains more of the variability of the Salmonidae family (SALM). The regression residues of SALM versus TEMP are related negatively to the relative abundance of fish species of Atherinidae (ATER) and Percichthyidae (PERC) families. These results are also valid when analyzing a subset of lakes and reservoirs with SALM equals to 0. The possibility that the community integrated by salmonids, atherinids and percichtids remains balanced in a lake has been hypothesized.
The principal components in management of lakes and reservoirs based on climatic, morphometric and edaphic variables allows us to distinguish four types of environments in which: a) exotic fishes have become established as reproducing populations, b) fish community is in the process of stabilization, c) established populations can last for more or less long time, and d) exotic have to be keep by successive stockings. The advantages of the comparative method of environmental management with respect to those of higher theoretical contents but supported on much more limited data bases are stressed.
10.2 INTRODUCCION
El que una especie colonice exitosamente un sistema dado, depende a) de las potencialidades fisiológica, de comportamiento y ecológicas de la especie exótica, y b) de las propiedades físicas y biológicas del ecosistema que reciba la introducción (Stauffer 1984, Taylor et al. 1984). Las especies introducidas con éxito, comúnmente tienen tolerancias fisiológicas, hábitos alimentarios o capacidades reproductivas que difieren de las de las especies nativas y que las preadaptan para establecerse en el nuevo ambiente (Taylor et al. 1984). Otro factor de importancia que determina el éxito de una introducción es la estructura de la comunidad de peces que “recibe” tal introducción.
La transferencia de una especie a un nuevo ambiente involucra el transportar individuos desde un ambiente con el cual la especie ha coevolucionado y al cual se ha adaptado, para liberarlos, en una proporción impredecible, de los factores que determinan la densidad y distribución de la especie (Taylor et al. 1984). Las probabilidades de una introducción exitosa son relativamente altas en comunidades simples, con baja diversidad de especies nativas, y en aquellos ambientes expuestos a perturbaciones físicas o biológicas (ver Taylor et al. 1984, para recopilación).
Durante la segunda mitad del siglo pasado y comienzos del presente, la introducción de salmónidos fue realizada a nivel mundial y sobre la mayor parte de los continentes (Mac Crimmon, 1971). Esto es válido en particular para el extremo sur de América (Campos, 1970; Baigún y Quirós, 1985). En la región Patagónica su introducción fue indicada como de efectos negativos sobre los stocks de peces de especies nativas, especialmente de las familias Galaxiidae y Aplochitonidae (Ringuelet, 1966; Campos, 1970).
La región Patagónica es de baja diversidad específica en sus formas nativas. Sólo han sido citadas 18 especies de peces autóctonas. La región central de Chile, que se extiende hasta la Provincia de Valdivia, cuenta con 26 especies, de las cuales sólo cinco son comunes con la región Patagónica (Ringuelet, 1975). La región pampásica de Argentina posee también comunidades de peces de baja diversidad específica; por ejemplo, la cuenca del río Salado, de Buenos Aires, cuenta con 24 especies correspondientes a 13 familias (Ringuelet, 1975).
En la región oeste y noroeste de Argentina, la diversidad específica es también baja, con excepción de los tramos superiores de los ríos que forman parte de la cuenca del Plata (Ringuelet, 1975). En estas dos últimas regiones, la mayor parte de los ambientes acuáticos con características leníticas son embalses; sus “comunidades” de peces no lo son en un sentido estricto -están compuestas por especies que han coevolucionado-sino que son agregados “astáticos” (Ryder y Kerr, 1978) de especies de peces “exóticos”, producto de la transferencia indiscriminada de especies introducidas (salmónidos) y de especies correspondientes a por lo menos otras dos regiones zoogeográficas (Ringuelet, 1975).
En la región Patagónica, si bien ninguna de las especies nativas constituye un piscívoro estricto, de dos especies del género Percichthys se ha informado que una alta proporción de su dieta esta compuesta por peces (Ferriz, com. pers.). Sin embargo, en todo el territorio de Argentina, la ausencia de especies de peces con las características predadoras de los salmónidos aseguran una condición favorable para su introducción exitosa. El regimen climático en Argentina ha sido mencionado como uno de los factores ecológicos controlantes de su dispersión, tanto en su dirección sur-norte (Baigún y Quirós, 1985) como este-oeste (Quirós y Baigún, 1986).
Las introducciones de salmónidos en Argentina pueden considerarse exitosas y han desarrollado poblaciones autosostenidas en lagos y embalses del sur y oeste del país. Si bien un estudio de impacto de introducción de peces debe recurrir a la experimentación con el fin de avanzar en las relaciones causa-efecto, la aplicación de métodos comparativos puede aportar evidencia de impacto (Taylor et al. 1984), aunque no sea capaz de revelar los mecanismos que subyacen en los patrones de diferencias observadas.
Dado el estado actual del conocimiento sobre los factores que determinan la actual distribución de salmónidos en Argentina, pretendemos que un enfoque comparativo nos permita avanzar en este sentido. Una de nuestras hipótesis de trabajo es que los intentos de introducir salmónidos han abarcado prácticamente todo el territorio del país, tal como está documentado en los registros de siembras realizadas (Baigún y Quirós, 1985).
Suponemos que en cada uno de los ambientes a considerar se intentó la introducción de por lo menos una especie de salmónido. En los ambientes en los cuales éstos han desarrollado poblaciones autosostenidas, el número de especies presentes puede llegar a ser de hasta tres. Se considera que no sería válida una suposición similar a nivel de especie, dado que no se registran siembras de varias especies de salmónidos para todos, o por lo menos para la mayoría, de los lagos y embalses considerados (Baigún y Quirós, 1985). Consideramos que dicha información, junto con sus resultados y la caracterización limnológica de los ambientes acuáticos, es de utilidad para analizar las condicionantes ecológicas de su distribución actual.
Los determinantes más generales de la producción de un ambiente acuático y de su comunidad de peces en particular, son sus características climáticas, morfométricas y edáficas. Pretendemos que, a escala global, la composición de la comunidad de peces es un determinante secundario de su producción, para comunidades que han coevolucionado con su ambiente. Dicha composición dependerá de los requerimientos vitales de cada una de las especies, así como de las interacciones intra e interespecíficas; asimismo, dependerá tanto de las características físicas y químicas como de las biológicas del sistema acuático.
En el presente trabajo se analizán los factores climáticos, morfométricos y edáficos que determinan la distribución de salmónidos en lagos y embalses de Argentina y su abundancia relativa, en relación con la abundancia relativa de las dos familias de especies nativas de peces más abundante en los ambientes estudiados, Percichthydae y Atherinidae.
10.3 MATERIALES Y METODOS
La base de datos disponible es producto de un programa de muestreo extensivo en 112 lagos y embalses de Argentina, realizado durante los veranos del período 1984–1987 por el Instituto Nacional de Investigación y Desarrollo Pesquero y la Provincia del Chubut. De ellos, sólo se analizan los 106 ambientes en los cuales se capturaron peces.
El conjunto de lagos y embalses está situado entre los 24° y 55° de latitud sur (Figura 1). Es sumamente heterogéneo en lo que respecta a sus características climáticas, morfométricas, edáficas e hidrológicas (Quirós, 1987). Incluye lagos y embalses ubicados en los Andes Patagónicos, en la planicie patagónica y en la Tierra del Fuego; lagos muy poco profundos (lagunas) en la región pampásica; y embalses y pequeños lagos de las regiones centro-oeste y noroeste de Argentina. Incluye también un lago de alta montaña y algunos lagos de alta salinidad (Tabla 1).
Los ambientes fueron muestreados una sola vez, con excepción de seis de ellos que fueron estudiados durante dos años. El muestreo de peces fue realizado con una batería de nueve redes agalleras y la metodología de muestreo ha sido descrita con anterioridad (Quirós y Biagún, 1986). El resto de la información fue obtenida según fuera descrito por Quirós et al. (1986) y Quirós (1987). Para ocho de los lagos, la profundidad media fue estimada a partir de la relación área versus profundiad media para otros lagos en la misma región, y a partir de la relación entre profundidad máxima de muestreo y la profundidad media (Quiró 1987).
En el presente trabajo sólo se consideran las capturas de especies de peces correspondientes a las familias Salmonidae, Atherinidae y Percichthyidae (Tabla 2). En la región patagónica no fueron consideradas las capturas de los géneros Aplochiton y Galaxias. dada su baja abundancia o por ser inaccesibles al arte pesquero utilizado. Los análisis de correlación y de componentes principales fueron realizados según Davis (1973), y los de regresión simple y múltiple, y de residuos, según Weisberg (1980).
Las variables consideradas en los análisis realizados son: SALM, ATER y PERC (abundancia relativa en las capturas de peces de las familias Salminidae, Atherinidae y Percichthyidae, respectivamente), A (área superficial), ZMEAN (profundidad media), LS (lectura de disco de Secchi), TEMP (temperatura media anual del aire), PLH (período libre de heladas), ALT (altitud), K20 (conductividad eléctrica), A/A (relación aniónica de carbonato más bicarbonato a sulfato más cloruro, en equivalentes), C/C (relación catiónica de calcio más magnesio o sodio más potasio, en equivalentes), LAT (latitud), CPUE (captura total de peces por unidad de esfuerzo), Ts y Tf (temperaturas de superficie (0.5 m) y de fondo, respectivamente, durante los muestreos) y DOs y DOf (oxígeno disuelto de superficie y de fondo, respectivamente, durante los muestreos).
10.4 RESULTADOS
Factores que afectan la distribución de salmónidos: El análisis de correlación simple indica que la variable TEMP es la que explica un mayor porcentaje en la variación de SALM, tanto en el análisis lineal como con TEMP transformada logarítmicamente. Para los tres conjuntos de lagos y embalses, los mayores coeficientes de correlación se obtienen con SALM transformada según arcsen (X) ^0.5 (Tabla 3). Si bien TEMP es la variable que aparece como más relacionada con SALM, los ambientes de mayor profundidad y transparencia, y con menores niveles de sólidos disueltos y aguas del tipo carbonatadas calcicomagnésicas, presentan mayor frecuencia relativa de salmónidos (Tabla 3).
Con el fin de visualizar la abundancia relativa de salmónidos en el espacio de las variables climáticas, morfométricas y edáficas consideradas, se realizó un análisis de ordenación de los 106 lagos y embalses, por componentes principales. Las ordenaciones realizadas linealmente y con las variables logarítmicamente transformadas no varían sustancialmente.
El primer eje de ordenación pesa positivamente las variables climáticas y las relacionadas con la térmica de los lagos y embalses (TEMP, PLH, Ts y Tf) y los niveles de sólidos disueltos (TDS), y negativamente con LS y ZMEAN, y explica un 54,9% de la variación total. El segundo eje pesa positivamente a DOf y negativamente a ALT, ZMEAN y la Ts, explicando un 15,1% de la variación total (Tabla 4). Este último da cuenta de los embalses de la región oeste y noroeste, con hipolimnio practicamente anóxico durante el verano (Tabla 1).
La ordenación obtenida permite dar cuenta de la varición de SALM en el espacio de los dos primeros ejes. La mayor proporción de salmónidos en la captura corresponde, en general, a ambientes con baja temperatura de superficie y de fondo, mayor profundidad y alta transparencia. La gran mayoría de los ambientes con SALM mayor a 0,90 quedan encerrados dentro de la zona A1 (Figura 2). Los requerimientos morfométricos (profundidad) y de transparencia pueden ser contrarrestados por altos niveles de oxígeno disuelto y menores temperaturas.
Por ejemplo, el ambiente 102, la laguna San Luis, en Tierra del Fuego, podría representar un ejemplo de caso límite de ambiente poco profundo, alta turbidez fitoplanctónica, baja temperatura media anual, y de fondo y superficie en verano, y alta proporción de salmónidos. Inmediatamente por encima se encuentra ubicado el ambiente 100, el lago Blanco, en la Provincia del Chubut, con características climáticas y físicas similares, pero con altos niveles de sólidos disueltos. A ello debe agregarse el que su alta turbidez es de origen inorgánico, su cuenca endorreica, y experimenta grandes variaciones en su superficie.
De los dos ambientes con SALM entre 0,90 y 1,0 que se ubican por fuera de la zona A1, lagunas Zeta y Brecham, en la Provincia de Chubut, no presentan poblaciones de salmónidos autosostenidas, sino que sus stocks son mantenidos en base a siembras repetidas. El resto de los ambientes con SALM mayor que cero y ubicados inmediatamente por fuera de la zona A1 y con mayores profundidades medias, corresponden a ambientes de precordillera, con niveles reducidos de oxígeno en el hipolimnio (87), y a ambientes ubicados en la planicie patagónica. Los ubicados inmediatamente por fuera de los anteriores, todos con SALM menor a 0,1, corresponden a ambientes ubicados por encima de los 800 m de altitud en la región centro-oeste de Argentina. Representarían casos límites de distribución de salmónidos en lagos y embalses, limitados fundamentalmente por temperatura.
Los ambientes ubicados en los dos cuadrantes superiores de la Figura 2 representan ambientes poco profundos en zonas templadas y tropicales y ambientes tipo embalse de la región oeste y noroeste, de mayor profundidad, que presentan estratificación térmica pero con un hipolimnio con bajos niveles de oxígeno disuelto.
En las Figuras 3, 4 y 5 se ubican los ambientes en función de las temperaturas y los niveles de oxígeno disuelto, en superficie y de fondo, durante los respectivos muestreos. Se indican el límite de concentración de oxígeno disuelto considerado como mínimo requerible para salmónidos (5,1 mg/m) y la media de temperatura óptima para crecimiento en salmónidos (Schlesinger y Regier, 1982) de 16°C. La temperatura óptima de crecimiento y la óptima para ganancia neta de biomasa es de 17°C para Oncorhynchus mykiss y de menos de 12°C para Salvelinus namaycush, siendo intermedias las de Salmo trutta y Salvelinus fontinalis (Schlesinger y Regier, 1982). Esto explicaría el que Oncorhynchus mykiss sea la especie de salmónido de distribución más septentrional y Salvelinus namaycush sólo esté presente en algunos de los lagos mas australes del conjunto considerado (Tabla 1).
Los ambientes en los cuales las temperaturas del hipolimnion son superiores a los 16°C durante el verano o los niveles de oxígeno disuelto son inferiores a 5,1 mg/m3, presentan serios problemas para el desarrollo de poblaciones autosostenidas de salmónidos, dado que no tendrían posibilidades de refugio para las condiciones adversas de temperatura y oxígeno disuelto durante el período estival.
De los ambientes que presentaron condiciones adversas de niveles de oxígeno disuelto de fondo, pero no de temperatura, 80 y 82 no poseen poblaciones autosostenidas de salmónidos; en el resto de los mismos la proporción de salmónidos fue inferior a 0,50. De los ambientes que presentaron condiciones adversas de temperatura, pero no de oxígeno disuelto, ninguno presenta una proporción de salmónidos superior a 0,10 (Figura 5).
El análisis de regresión múltiple permite analizar las relaciones entre SALM y el resto de las variables consideradas. La primera fue tomada como variable dependiente y el resto como predictoras de la misma. En todos los casos, TEMP es la variable que explica el mayor porcentaje de la variación en SALMO (Tabla 3). Dado que esta última variable se encuentra acotada entre los valores 0 y 1 en su rango lineal, también se probaron distintos modelos de ajuste no lineal (Schnute, 1982), de los cuales se seleccionó el que presentó la menor suma de cuadrados residuales (RSS). En este caso TEP “explicó”, en general, un mayor porcentaje de la variación en Salmo (Tabla 5).
El sacar del conjunto bajo análisis los cinco ambientes ubicados en la región patagónica que presentaron valores de SALM iguales a cero, para cada uno de los tres conjuntos de lagos y embalses, mejora sustancialmente el grado de ajuste a la curva SALM versus TEMP (Tabla 5). Dos de ellos (95 y 97) presentaron niveles excesivamente altos de turbidez inorgánica, posiblemente referida a su gran tamaño en relación con su profundidad media y conductividad eléctrica superior a 1999 uS/cm.
Los lagos Lezama y Posadas (79 y 99) presentan características similares a otros lagos de origen glacial y no poseemos a la fecha información que nos permita explicar la ausencia total de salmónidos en los mismos. El restante lago (88) ya fue reportado como sujeto de acción antrópica con anterioridad (Quirós y Baigún, 1986). De los cinco lagos, tres (79, 97 y 99) se presentan como claros casos excepcionales (“outliers”) en el análisis de los residuos de SALM versus TEMP.
La presencia en la base de datos de un número excesivo de ambientes con SALM = 0 provocaría cierto grado de distorsión de la misma. Con el fin de visualizar tal efecto, todo el análisis fue realizado sólo con los lagos y embalses que presentaron SALM = 0 (n = 52). Los resultados son esencialmente similares a los obtenidos para el conjunto total; TEMP es la variable más importante en explicar la variación en SALM (Tablas 3 y 5).
Relación de los salmónidos con percíctidos y aterínidos: Si en el análisis de correlación de SALM también consideramos las variables ATER y PERC transformadas según arcsen (X) ^0.5 (Tabla 6), ATER es la segunda variable en orden de importancia (Tabla 3) en explicar la variabilidad en SALM, y la relación con PERC solo resulta significativa para n = 52.
Al realizar un análisis de residuos de las regresiones de SALM versus TEMP (Tabla 5), PERC resultó la variable de mayor importancia en explicar la distribución de los mismos, para n=106 y n=101. Este resultado avalaría que, en principio, PERC sería la segunda variable a introducir en una regresión múltiple, con el fin de predecir la abundancia relativa de salmónidos en regiones en las cuales hipotéticamente nunca fue intentada su introducción y en las cuales no se poseen otros datos para predecir el éxito de la misma (Tabla 7).
Para n = 52, ATER es la variable que pressenta la mayor relación con los residuos de la regresión de SALM versus TEMP. La ecuación de regresión resultante sería utilizable para predecir el éxito de una introducción en regiones en las cuales ésta fue intentada con éxito en algunos ambientes y con fracasos o abundancias relativas muy bajas en otros. En ningún caso la variable CPUE, como correlato de la abundancia total de peces, tuvo importancia significativa en explicar la variación en SALM, aun después de eliminado el efecto de TEMP.
10.5 DISCUSION Y CONCLUSIONES
La temperatura media anual del aire aparece como el factor ecológico de mayor importancia en limitar la distribución de salmónidos. Su importancia se afirma al mantenerse dicha característica para dos conjuntos de lagos y embalses que difieren sustancialmente en el número de ambientes considerados. Si bien el análisis realizado, a nivel de familia, es demasiado grosero, las características de las tres familias de peces consideradas hace que sus elementos componentes (especies) sean mucho más similares entre sí -en sus requerimientos vitales-que entre elementos de las distintas familias.
El hecho de que no se intentara introducir todas las especies de salmónidos en todos los ambientes considerados no nos permite avanzar con el análisis hasta el nivel de especie, incluyendo la interacción entre las mismas especies introducidas (Baigún y Quirós, 1985). Algunos hechos tales como la ausencia de Salmo trutta en las regiones oeste y noroeste y en ciertas zonas de la Patagonia, la presencia de Salvelinus namaycush sólo en los ambientes más australes del continente, la dispersión de Oncorhynchus mykiss en práctica-mente todos los ambientes patagónicos y el ser esta última especie la única presente en ambientes del oeste y noroeste, con excepción del lago de alta montaña, podrían ser explicados en parte por las variables consideradas, en particular TEMP (Baigún y Quirós, 1985). Su presencia en el total de ambientes analizados coincide con los requerimientos térmicos citados para estas especies (Schlesinger y Regier 1982) pero, no podemos separar este efecto de la componente histórica de que se haya intentado o no su introducción.
La diferencia entre las regresiones obtenidas para n = 106 y 101 con la obtenida para n = 52 podría deberse a que, en la segunda, prácticamente se han eliminado los ambientes de la pampasia y del norte de Argentina, con la presencia de una de las dos especies de aterínidos, Odontesthes bonariensis, y que casi no presentaron capturas de percíctidos. Por otra parte, el análisis para n = 52 presenta la seguridad de que se han eliminado los ambientes en los cuales nunca se intentó la introducción de salmónidos. En n = 52 quedan incluidos los ambientes patagónicos al sur del río Colorado y hasta la Tierra del Fuego, algunos embalses del centro-oeste, un lago de altura del centro-oeste y un pequeño lago, de 1500 m de altitud, en el norte, cuyos stocks de salmónidos son producto de siembras repetidas.
Los ambientes del centro-oeste, del norte en altura y los de la planicie patagónica, al norte de la Tierra del Fuego, representarían casos limítrofes de distribución de salmónidos en Argentina (Figura 2). En muchos de estos últimos ambientes, la presencia de salmónidos se debe a la siembra repetida de los mismos, a despecho de que en algunos pueda producirse su reproducción y el establecimiento de poblaciones por períodos de tiempo más o menos prolongados.
La relación negativa entre SALM y ATER y PERC queda afirmada por el hecho de que en el análisis de residuos de las regresiones de SALM versus TEMP, la segunda variable de importancia en explicar su distribución es ATER para n = 106 y n = 101 y PERC para n = 52. El efecto negativo de ATER sobre SALM es más firme que el efecto negativo de PERC, dado que surge del análisis de una base de datos en la cual la introducción de salmónidos fue realizada en todos los ambientes.
En última instancia, no es posible descartar la co-influencia de una variable no considerada en nuestro análisis o un efecto debido a que SALM, ATER y PERC constituyen un tipo particular de variables acotadas entre dos valores fijos, y cuando una aumenta, la suma de las otras dos casi necesariamente disminuye (Tabla 1).
La relación negativa entre la abundancia relativa de salmónidos y las de percíctidos y aterínidos, nos serviría para hipotetizar sobre el efecto negativo de la introducción de aterínidos o percíctidos en ambientes mesotróficos con poblaciones autosostenidas de Oncorrhynchus mykiss (Baigún y Quirós, 1985). Nuestros resultados apoyan la existencia de una determinación ambiental, que favorecería o desfavorecería el establecimiento de un nuevo elemento introducido al sistema.
La mencionada relación negativa también podría interpretarse como resultado del efecto negativo (disminución de la abundancia relativa) producido por la introducción de salmónidos sobre percíctidos y aterínidos. Si bien una de las respuestas posibles para las comunidades de peces que han co-evolucionado con su ambiente, sería la de disminuir la abundancia relativa de sus especies nativas frente a la introducción del exótico (a estructura de trama trófica aproximadamente constante), la sola observación del estado actual no sólo no nos permite hipotetizar sobre posibles mecanismos, sino que no permite adjudicar direccionalidad de causa-efecto. Lo que sí parece evidente es que el éxito de la introducción, o su efecto negativo sobre las especies nativas, tiene una importante ambiental determinante.
Aunque ello parecería no ser un avance teórico de importancia, sí lo es desde el punto de vista práctico, frente al método de prueba y error que fue utilizado hasta la fecha en Argentina. Con una ordenación ambiental como la realizada, antes de intentar una introducción es posible predecir el efecto que tendrá la misma sobre la ictiofauna presente en un ambiente de características ambientales dadas. Resumiendo, a partir de la caracterización ambiental de un lago dado, poseemos elementos para predecir si sus actuales poblaciones de salmónidos se verán desfavorecidas por la introducción de aterínidos o percíctidos, o si sus actuales poblaciones de percíctidos o aterínidos se verán desfavorecidas frente a la introducción de salmónidos.
Nuestros resultados apoyan la predicción de que un ambiente estabilizado, con poblaciones autosostenidas y balanceadas de aterínidos, percíctidos y salmónidos, es poco probable, a menos que el ambiente posea una gran heterogeneidad espacial. Tal podría ser el caso de algunos de los lagos patagónicos de origen glacial, con sub-ambientes muy profundos hacia la Cordillera de los Andes y sub-ambientes de menor profundidad y con ciertas características de los lagos de precordillera y de meseta hacia el este (Quirós et al. 1986).
Al hecho de la siembra indiscriminada de salmónidos en todo el territorio de Argentina, debe agregarse la de aterínidos nativos de la pampasia y la de percíctidos de la planicie patagónica por toda la región oeste y noroeste del país. El poder predecir antes de intentar un programa de siembra, parecería no ser poca importancia práctica en la Argentina. Aparentemente, la “esperimentación” realizada a escala macro, es por ahora suficiente. El presente es el primer intento para comenzar a analizar sus resultados.
La ordenación de ambientes acuáticos en función de sus propiedades climáticas, morfométricas y edáficas constituye un método adecuado para el manejo pesquero de un gran número de ambientes, en particular cuando los recursos disponibles son de carácter limitado (Quirós 1986, Henderson et al., 1987; Quirós y Marí, en prep.).
En el caso de la introducción de especies en escala amplia, tal como la de los salmónidos a escala continental y mundial, resulta una metodología adecuada para visualizar los factores ecológicos que limitan su dispersión y una herramienta de manejo de importancia para: a) predecir las características de los ambientes en los cuales una introducción dada se vería favorecida; b) identificar los posibles casos limítrofes de introducción en los cuales el exótico desarrollará poblaciones que permanecerán períodos mas o menos prolongados de tiempo y con bajas abundancias relativas; c) identificar ambientes en los cuales los stocks del exótico deberán necesariamente ser mantenidas por medio de siembras sucesivas; y d) avanzar en la comprensión de las relaciones globales entre las especies nativas y las introducidas.
En cuanto a la utilización de los métodos de ordenación de ambientes acuáticos con fines de manejo de introducción de especies de peces, el conjunto de variables a utilizar en la ordenación deberá incluir, en un principio, variables que den cuenta del “medio ambiente inmediato” de los peces, tales como la temperatura del agua, los niveles de oxígeno disuelto, los niveles y tipo de turbidez o salinidad, además de las características que configuran el “medio ambiente mediato”, determinantes de la producción potencial del ambiente acuático, tales como la temperatura media anual del aire, los niveles de nutrientes, la profundidad media o el tiempo medio de permanencia del agua.
Es de esperar que el “medio ambiente inmediato” de los peces esté determinado por el “medio ambiente mediato”, pero con fines prácticos ello deberá surgir de la covariación en el análisis mutlivariado de ordenación. La variación residual, de la cual no da cuenta la ordenación ambiental, será explicada por los limitantes biológicos al exótico, como por ejemplo la competencia interespecífica.
Consideramos este enfoque como de mayor seguridad en las predicciones obtenidas, y un paso previo imprescindible en la evaluación ecológica previa del impecto a producirse por la introducción de un exótico, frente al enfoque que parte directamento del concepto de “nicho ecológico” y se basa principalmente en las variables (dimensiones) del “medio ambiente inmediato” de los peces y en la competencia por algunos de los recursos.
10.6 AGRADECIMIENTOS
El presente trabajo es resultado de un proyecto financiado por el Instituto Nacional de Investigación y Desarrollo Pesquero, la Provincia del Chubut y el Consejo Nacional de Investigaciones Científicas y Técnicas, por medio del subsidio PID 3-017400/85. Se agradece a todo el personal científico y técnico del Instituto Nacional de Investigación y Desarrollo Pesquero, como asimismo al de la Provincia del Chubut, el esfuerzo realizado para completar con éxito el programa de muestreo.
10.7 REFERENCIAS
BAIGUN, C.R.M. y QUIROS, R. 1985. Introducción de peces exóticos en la República Argentina. EN: Informes Técnicos del Dpto. de Aguas Continentales № 2. Mar del Plata, Argentina, Inst. Nac. de Investigación y Desarrollo Pesquero. 90 p.
CAMPOS, H. 1970. Introducción de especies exóticas y su relación con los peces de agua dulce de Chile. EN: Notas Mens. Mus. Nac. Hist. Nat. Santiago, Chile. 14:3–10.
DAVIS, J.C. 1973. Statistics and data analysis in geology. New York, USA, John Wiley and Sons. 550 p.
HENDERSON, F., MARI, A. y QUIROS, R. 1987. Research strategies for managing the fisheries of a set of water bodies. In press.
MacCRIMONn, H.R. 1971. World distribution of rainbow trout (Salmo gairdneri). IN: J. Fish. Res. Board Canada. 28:461–509.
QUIROS, R. 1986. Ordenación y clasificación de embalses de la República de Cuba. EN: Informe Proyecto PNUD/FAO/CUB/81/004. La Habana, Cuba. 26 p.
QUIROS, R. 1987. Relationships between air temperature, depth, nutrients and chlorophyll in 103 Argentinian lakes. IN: Verh. Int. Ver. Limnol. 23:1107–1123. In press.
QUIROS, R. and MAR, A. 1988. Cuban reservoirs ordination for fisheries management. In press.
QUIROS, R. and BAIGUN, C. 1986. Prospección pesquera en 33 embalses y lagos patagónicos (Argentina). IN: Vila, I. and Fagetti, E., Eds. Trabajos presentados al Taller Int. sobre Ecología y manejo de peces en lagos y embalses. Santiago, Chile, 5–10 de noviembre 1984. COPESCAL. Documento Técnico 4. pp. 159–179.
QUIROS, R., CUCH, S. y BAIGUN, C. 1986. Relación entre abundancia de peces y ciertas propiedades físicas, químicas y biológicas, en lagos y embalses patagónicos (Argentina). EN: Vila, I. y Fagetti, E., Eds. Trabajos presentados al Taller Internacional sobre Ecología y manejo de peces en lagos y embalses. Santiago, Chile, 5–10 de noviembre 1984. COPESCAL. Documento Técnico 4. pp. 180–202.
RINGUELET, R.A. 1966. La introducción de peces exóticos en la Argentina. EN: Boletín Informativo Dirección de Recursos Pesqueros. La Plata, Argentina. 5:5–7.
RINGUELET, R.A. 1975. Zoogeografía y ecología de los peces de aguas continentales de la Argentina y consideraciones sobre las áreas ictiológicas de Américadel Sur. EN: ECOSUR. 2:1–122.
RYDER, R.A. and KERR, S.R. 1978. The adult walleye in the percid community; a niche definition based on feeding behaviour and food specifity. IN: R.L. Kendall, Ed. Selected coolwater fishes of North America. American Fisheries Society. Special Publication № 11. pp. 39–51.
SCHNUTE, J. 1982. A manual for easy nonlinear parameters estimation in fishery research with interactive microcomputer programs. IN: Can. Tech. Rep. Fish. Aquat. Sci. 1140. 115 p.
STAUFFER, J.R. Jr. 1984. Colonization theory relative to introduced populations. IN: Courtenay, W.R. Jr. and Stauffer, J.R. Jr., Eds. Distribution, biology and management of exotic fishes. Baltimore, USA, Johns Hopkins Univ. Press. pp. 8–21.
TAYLOR, J.N., COURTENAY, W.R. Jr. and McCANN, J.A. 1984. Known impacts of exotic fishes in the continental United States. IN: Courtenay, W.R. Jr. and Stauffer, J.R. Jr., Eds. Distribution, biology and management of exotic fishes. Baltimore, USA, Johns Hopkins Univ. Press. pp. 322–373.
WEISBERG, S. 1980. Applied linear regression. New York, U.S.A., John Wiley and Sons. Inc. 283 p.
Tabla 1. Lagos (L) y embalses (R) de Argentina. Area (A, km2), profundidad media (ZMEAN, m), altitud (ALT, m), latitud (LAT, S)., temperatura media anual del aire (TEMP, C), abundancias relativas de Salmonidae, Atherinidae y Percichthyidae (SALM, ATER y PERC respectivamente) y especies de peces de las familias Salmonidae, Atherinidae y Percichthyidae (ESP, ver Tabla 2) capturadas.
| A | ZMEAN | ALT | LAT | TEMP | SALM | ATER | PERC | ESP | |
| 1. Rodeo(L) | 0.09 | 3.6 | 1446 | 24.12 | 16 | .06 | .04 | .90 | 1,9,6 |
| 2. Comedero(L) | 0.12 | 4.0 | 1446 | 24.12 | 16 | .0 | 1. | .0 | 6 |
| 3. La Cienaga(R) | 2.8 | 9.3 | 1212 | 24.47 | 17.5 | .0 | .31 | .0 | 6 |
| 4. Las Maderas(R) | 9.6 | 31.3 | 1185 | 24.45 | 18 | .0 | .19 | .0 | 6 |
| 5. Campo Alegre(R) | 3.2 | 14.4 | 1200 | 24.63 | 19 | .0 | .53 | .0 | 6 |
| 6. Cabra Corral(R) | 115 | 27.0 | 1037 | 25.30 | 17 | .0 | .25 | .0 | 6 |
| 7. El Cadillal(R) | 13.5 | 22.2 | 611 | 26.62 | 18 | .0 | .04 | .0 | 6 |
| 8. Rio Hondo(R) | 330 | 5.3 | 275 | 27.50 | 20 | .0 | .0001 | .0 | 6 |
| 9. Sumampa(R) | 2.2 | 10.0 | 516 | 27.95 | 20 | .0 | 1. | .0 | 6 |
| 10.Las Pirquitas(R) | 2.8 | 26.8 | 759 | 28.33 | 20 | .0 | .57 | .005 | 6,9 |
| 11.Los Sauces(R) | 1.5 | 8.1 | 847 | 29.42 | 20.4 | .0 | .95 | .0 | 6 |
| 12.Anzulon(R) | 5.5 | 4.9 | 575 | 30.88 | 19 | .0 | 1. | .0 | 6 |
| 13.Portezuelo(R) | 2.5 | 3.3 | 750 | 30.67 | 18 | .0 | 1. | .0 | 6 |
| 14.Cruz del Eje(R) | 13.5 | 9.5 | 500 | 30.77 | 19.3 | .0 | .08 | .0 | 6 |
| 15.Mar Chiquita(L) | 1984 | 7.3 | 69 | 30.70 | 18.5 | .0 | 1. | .0 | 6 |
| 16.Saladillo(R) | 4.8 | 3.0 | 600 | 31.00 | 19 | .0 | 1. | .0 | 6 |
| 17.San Roque(R) | 24.8 | 14.1 | 640 | 31.42 | 17 | .0 | .25 | .0 | 6 |
| 18.Ullum(R) | 32.0 | 14.0 | 768 | 31.53 | 17.3 | .02 | .33 | .0 | 1,6 |
| 19.La Vina(R) | 10.5 | 23.0 | 846 | 31.85 | 16.9 | .0 | .32 | .0 | 6 |
| 20.Los Molinos(R) | 24.5 | 16.3 | 770 | 31.83 | 16 | .0 | .02 | .0 | 6 |
| 21.Rio Tercero(R) | 54.3 | 13.5 | 661 | 32.22 | 16.7 | .0 | .13 | .0 | 6 |
| 22.San Felipe(R) | 15.4 | 7.1 | 843 | 32.78 | 16.5 | .0 | 1. | .0 | 6 |
| 23.La Florida(R) | 7.0 | 15.0 | 1032 | 33.18 | 16 | .01 | .27 | .71 | 1,6,9 |
| 24.El Carrizal(R) | 32.0 | 12.2 | 790 | 33.33 | 15 | .02 | .66 | .03 | 1,6,9 |
| 25.El Diamante(L) | 13.4 | 38.6 | 3250 | 34.17 | 3 | 1.0 | .0 | .0 | 4 |
| 26.Agua del Toro(R) | 10.5 | 36.2 | 1339 | 34.62 | 12 | .0 | 1. | .0 | 6 |
| 27.Los Reyunos(R) | 7.5 | 33.3 | 991 | 34.65 | 13 | .07 | .93 | .0 | 1,6 |
| 28.Valle Grande(R) | 5.1 | 33.0 | 814 | 34.80 | 13 | .0 | .05 | .95 | 1,9 |
| 29.El Nihuil(R) | 96 | 4.0 | 1325 | 35.70 | 11 | .01 | .02 | .97 | 1,7,9 |
| 30.Melincue(L) | 48.2 | 3.2 | 97 | 33.72 | 16.5 | .0 | .78 | .0 | 6 |
| 31.El Carpincho(L) | 4.4 | 1.2 | 70 | 34.58 | 15.8 | .0 | .44 | .0 | 6 |
| 32.De Gomez(L) | 36.6 | 1.1 | 75 | 34.63 | 15.8 | .0 | .38 | .0 | 6 |
| 33.Navarro(L) | 2.1 | 0.7 | 30 | 35.05 | 16.3 | .0 | .0 | .0 | - |
| 34.Las Mulitas(L) | 1.4 | 1.5 | 40 | 35.43 | 15.5 | .0 | .76 | .0 | 6 |
| 35.De Lobos(L) | 7.5 | 1.2 | 20 | 35.27 | 16 | .0 | .11 | .0 | 6 |
| 36.Indio Muerto(L) | 6.3 | 1.6 | 35 | 35.45 | 16 | .0 | .0 | .0 | - |
| 37.De Monte(L) | 6.4 | 1.4 | 20 | 35.45 | 16 | .0 | .19 | .0 | 6 |
| 38.La Chilca(L) | 10.0 | 1.5 | 55 | 35.78 | 15.5 | .0 | .02 | .0 | 6 |
| 39.Chascomus(L) | 28.7 | 1.5 | 7 | 35.60 | 16.5 | .0 | .06 | .0 | 6 |
| 40.La Limpia(L) | 5.6 | 1.9 | 10 | 35.62 | 16.5 | .0 | .12 | .0 | 6 |
| 41.La Tablilla(L) | 12.9 | 1.1 | 9 | 35.80 | 16 | .0 | .0 | .0 | - |
| 42.Blanca Grande(L) | 4.1 | 1.5 | 100 | 36.47 | 15 | .0 | .55 | .0 | 6 |
| 43.Alsina(L) | 25.7 | 1.1 | 105 | 36.88 | 15 | .0 | .81 | .0 | 6 |
| 44.Cochico(L) | 36.6 | 1.9 | 103 | 36.92 | 15 | .0 | .86 | .0 | 6 |
| 45.Salada Grande(L) | 48.1 | 2.0 | 2 | 36.92 | 14.5 | .0 | .0 | .0 | - |
| 46.Los Horcones(L) | 2.0 | 1.3 | 5 | 37.00 | 14.5 | .0 | .54 | .0 | 6 |
| 47.Del Monte(L) | 80.1 | 5.2 | 100 | 37.00 | 15 | .0 | .29 | .0 | 6 |
| 48.Del Venado(L) | 25.3 | 3.8 | 97 | 37.08 | 15 | .0 | 1.0 | .0 | 6 |
| 49.La Brava(L) | 4.3 | 3.4 | 70 | 37.88 | 14 | .0 | .90 | .0 | 6 |
| 50.De Los Padres(L) | 2.9 | 2.7 | 50 | 37.87 | 13.8 | .0 | .0 | .0 | - |
| 51.De Pigue(L) | 6.4 | 2.5 | 250 | 38.05 | 14 | .0 | .35 | .0 | 6 |
| 52.De Saavedra(L) | 4.5 | 2.7 | 253 | 38.03 | 14 | .0 | .61 | .0 | 6 |
| 53.La Dulce(L) | 49.0 | 3.8 | 230 | 38.05 | 15 | .0 | .82 | .0 | 6,7 |
| 54.Urre Lauquen | 62.9 | 1.6 | 230 | 38.08 | 15 | .0 | .39 | .0 | 6,7 |
| 55.Sauce Grande(L) | 18.2 | 2.1 | 11 | 38.95 | 14.5 | .0 | .62 | .0 | 6 |
| 56.Pellegrini(L) | 100.7 | 9.4 | 270 | 38.41 | 14.5 | .0 | .63 | .37 | 6,7,8,9 |
| 57.Mari Menuco(R) | 174 | 79.4 | 421 | 38.58 | 13 | .07 | .43 | .50 | 1,7,8,9 |
| 58.Los Barreales(R) | 411 | 68.3 | 422 | 38.53 | 13 | .36 | .04 | .59 | 1,7,8,9 |
| 59.Blanca(L) | 17.0 | 8.4 | 1230 | 39.05 | 10 | .43 | .0 | .57 | 1,9 |
| 60.Alumine(L) | 57.0 | 69.4 | 1125 | 38.92 | 4 | 1.0 | .0 | .0 | 1 |
| 61.Ramos Mexia(R) | 816 | 24.7 | 381 | 39.42 | 12 | .48 | .12 | .41 | 1,2,7,8,9 |
| 62.Norquinco(L) | 5.4 | 41.9 | 1025 | 39.15 | 3 | .94 | .0 | .05 | 1,2,4,9 |
| 63.Quillen(L) | 23.0 | 59.0 | 975 | 39.42 | 4 | .45 | .32 | .23 | 1,7,9 |
| 64.Huechulafquen(L) | 78.2 | 142 | 875 | 39.77 | 5 | 1.0 | .0 | .0 | 1,2 |
| 65.Lacar(L) | 49.0 | 166 | 625 | 40.17 | 5 | .95 | .0 | .04 | 1,2,9 |
| 66.Nahuel Huapi(L) | 557 | 157 | 764 | 40.88 | 5 | .42 | .37 | .21 | 1,3,7,9 |
| 67.Gutierrez(L) | 16.4 | 79.7 | 750 | 41.20 | 5 | 1.0 | .0 | .0 | 1 |
| 68.Ne Luan(L) | 0.6 | 6.4 | 1000 | 40.88 | 9.6 | .72 | .28 | .0 | 1,7 |
| 69.Mascardi(L) | 39.2 | 111 | 750 | 41.30 | 5 | 1.0 | .0 | .0 | 1,2,4 |
| 70.Guillelmo(L) | 5.4 | 61.3 | 826 | 41.38 | 5 | 1.0 | .0 | .0 | 1,4 |
| 71.Steffen(L) | 6.3 | 46.7 | 525 | 41.52 | 6 | 1.0 | .0 | .0 | 1,2 |
| 72.Las Chultas(L) | 0.6 | 11.4 | 585 | 42.17 | 7 | .97 | .0 | .0 | 4 |
| 73.Epuyen(L) | 17.4 | 92.4 | 250 | 42.17 | 5 | .26 | .04 | .68 | 1,4,7,9 |
| 74.Puelo(L) | 44.0 | 111 | 150 | 42.17 | 5 | .50 | .05 | .45 | 1,2,7,9 |
| 75.Cholila(L) | 17.5 | (48.5) | 540 | 42.47 | 5 | .99 | .0 | .01 | 1,4,5,9 |
| 76.Lezama(L) | 7.5 | 36.0 | 750 | 42.45 | 6 | .0 | .53 | .47 | 7,9 |
| 77.Los Mosquitos(L) | 4.6 | ( 6.1) | 500 | 42.50 | 7 | .25 | .64 | .11 | 1,7,9 |
| 78.Rivadavia(L) | 21.7 | 104 | 527 | 42.57 | 5 | .94 | .0 | .03 | 1,2,4,9 |
| 79.Esquel(L) | 2.8 | 2.1 | 650 | 42.88 | 8 | .40 | .0 | .60 | 1,9 |
| 80.Brecham(L) | 0.3 | 3.3 | 480 | 42.90 | 8 | .99 | .0 | .0 | 1 |
| 81.Verde(L) | 1.4 | 18.3 | 520 | 42.72 | 5 | .80 | .0 | .20 | 1,2,9 |
| 82.Zeta(L) | 0.8 | 5.9 | 850 | 42.88 | 8 | .94 | .0 | .0 | 1 |
| 83.Largo(L) | 2.8 | 19.5 | 800 | 42.90 | 5 | 1.0 | .0 | .0 | 2 |
| 84.Terraplen(L) | 2.7 | 3.5 | 750 | 42.98 | 6 | .13 | .84 | .04 | 1,7,9 |
| 85.Amutui Quimei(R) | 86.7 | 64.7 | 502 | 42.88 | 5 | .99 | .0 | .0 | 1,2,4 |
| 86.Futalaufquen(L) | 44.6 | 101 | 518 | 42.83 | 5 | .92 | .0 | .08 | 1,2,4,9 |
| 87.Rosario(L) | 14.5 | 24.9 | 650 | 43.25 | 8 | .24 | .71 | .0 | 1,7 |
| 88.Cronometro(L) | 5.8 | 4.4 | 850 | 43.25 | 8 | .0 | .0 | .53 | 9 |
| 89.Los Ninos(L) | 0.7 | 4.3 | 900 | 44.87 | 7 | 1.0 | .0 | .0 | 4 |
| 90.Pico 4(L) | 5.3 | 6.8 | 550 | 44.27 | 5 | 1.0 | .0 | .0 | 1 |
| 91.Pico 3(L) | 4.5 | 3.8 | 550 | 44.20 | 5 | 1.0 | .0 | .0 | 1 |
| 92.Pico 1(L) | 12.0 | 41.0 | 550 | 44.25 | 5 | 1.0 | .0 | .0 | 1 |
| 93.La Plata(L) | 76.0 | (97.0) | 940 | 44.87 | 5 | 1.0 | .0 | .0 | 1,4 |
| 94.Fontana(L) | 81.5 | (79.0) | 930 | 44.93 | 5 | 1.0 | .0 | .0 | 1,4 |
| 95.Blanco(L) | 31.7 | ( 0.7) | 550 | 45.90 | 5 | .0 | .0 | .5 | 9 |
| 96.Muster(L) | 414 | 20.0 | 275 | 45.37 | 10.9 | .08 | .06 | .86 | 1,7,8,9 |
| 97.Colhue Huapi(L) | 810 | 2.0 | 265 | 45.50 | 10.9 | .0 | .03 | .98 | 7,8,9 |
| 98.Ameghino(R) | 65.0 | 24.6 | 169 | 44.10 | 11 | .06 | .26 | .68 | 1,7,8,9 |
| 99.Posadas(L) | 45.3 | 31.2 | 112 | 47.50 | 4.5 | .0 | .25 | .63 | 7,9 |
| 100.Cardiel(L) | 460 | 49.1 | 275 | 48.95 | 5.5 | 1.0 | .0 | .0 | 1,4 |
| 101.Roca(L) | 6.4 | 22.4 | 200 | 50.53 | 5 | .995 | .0 | .005 | 1,3,9 |
| 102.San Luis(L) | 6.0 | 1.1 | 15 | 53.92 | 5 | .997 | .0 | .0 | 1,2 |
| 103.Yehuin(L) | 43.5 | 42.7 | 241 | 54.37 | 5.5 | 1.0 | .0 | .0 | 4 |
| 104.Fagnano(L) | 580 | 80.7 | 140 | 54.57 | 5.5 | 1.0 | .0 | .0 | 1,2,4 |
| 105.Escondido(L) | 7.0 | 38.0 | 142 | 54.65 | 5 | 1.0 | .0 | .0 | 4 |
| 106.Argentino(L) | 1466 | (150) | 187 | 50.25 | 6 | .97 | .0 | .03 | 1,3,9 |
Tabla 2. Especies de peces consideradas en las variables SALM (Salmonidae), ATER (Atherinidae) y PERC (Percichthyidae).
| Salmonidae | 1. | Salmo gairdneri |
| 2. | Salmo trutta | |
| 3. | Salvelinus namaycush | |
| 4. | Salvelinus fontinalis | |
| 5. | Salmo salar sebago | |
| Atherinidae | 6. | Basilichthys bonariensis |
| 7. | Basilichthys microlepidotus | |
| Percichthyidae | 8. | Percichthys colhuapiensis |
| 9. | Percichthys trucha |
Tabla 3. Coeficientes de correlación entre SALM, transformada según arcsen (X)^0.5, y las distintas variables consideradas en el análisis (ver explicación en el texto).
| n=106 | n=101 | n=52 | |
| A | 0.050 | 0.066 | -0.014 |
| ZMEAN | 0.551 @ | 0.550 @ | 0.252 |
| LS | 0.682 @ | 0.714 @ | 0.431 @ |
| TEMP | -0.831 @ | -0.900 @ | -0.776 @ |
| PLH | -0.831 @ | -0.895 @ | -0.744 @ |
| ALT | 0.216 | 0.217 | -0.051 |
| K20 | -0.246 @ | -0.254 @ | -0.141 |
| A/A | 0.399 @ | 0.443 @ | 0.138 |
| C/C | 0.393 @ | 0.388 @ | 0.090 |
| LAT | 0.660 @ | 0.731 @ | 0.554 @ |
| Ts | -0.761 @ | -0.853 @ | -0.659 @ |
| Tf | -0.749 @ | -0.810 @ | -0.541 @ |
| DOf | 0.472 @ | 0.520 @ | 0.528 @ |
Tabla 4. Primeros tres autovectores correspondientes a la ordenación de 106 lagos y embalses por componentes principales. Variables transformadas logaritmicamente y normalizadas. Autovalores (k) y porcentaje de la variación total explicada.
| k | 5.488 | 1.510 | 0.988 |
| % | 54.88 | 15.10 | 9.88 |
| ZMEAN | -0.331 | -0.332 | -0.094 |
| LS | -0.350 | -0.200 | -0.205 |
| TEMP | 0.386 | -0.226 | 0.034 |
| PLH | 0.371 | -0.170 | 0.052 |
| ALT | -0.221 | -0.511 | 0.182 |
| TDS | 0.328 | 0.241 | 0.050 |
| Ts | 0.351 | -0.283 | -0.080 |
| Tf | 0.402 | -0.025 | -0.024 |
| DOs | -0.109 | 0.113 | 0.934 |
Tabla 5. Ecuaciones de regresión de SALM versus TEMP.
| n | ecuacion | r^2 | F |
| 106 | SALM = 1,694 - 0.102 TEMP | 0.69 | 232.9 @ |
| 101 | SALM = 1.850 - 0.112 TEMP | 0.81 | 421.7 @ |
| 52 | SALM = 1.921 - 0.116 TEMP | 0.60 | 75.5 @ |
| 106 | SALM = 1/ (1+ 0.0172 exp (0.50 TEMP)) | 0.73 | |
| 101 | SALM = 1/ (1+ 0.0062 exp (0.57 TEMP)) | 0.85 | |
| 52 | SALM = 1/ (1+ 0.0098 exp (0.51 TEMP)) | 0.63 |
Tabla 6. Coeficientes de correlación de SALM versus ATER y PERC transformadas segun arcsen (X)^0.5, y CPUE.
| n=106 | n=101 | n=52 | |
| ATER | -0.605 @ | -0.635 @ | -0.749 @ |
| PERC | -0.138 | -0.069 | -0.728 @ |
| CPUE | -0.279 @ | -0.307 @ | -0.110 |
Tabla 7. Ecuaciones de regresión múltiple de SALM versus TEMP, ATER y PERC.
| n | ecuacion | R^2 | F |
| 106 | SALM = 1.868 - 0.109 TEMP - 0.502 PERC | 0.77 | 175.9 @ |
| 101 | SALM = 1.937 - 0.114 TEMP - 0.340 PERC | 0.84 | 259.8 @ |
| 52 | SALM = 1.813 - 0.080 TEMP - 0.734 ATER | 0.77 | 82.1 @ |
Figura 1. Ubicación geográfica de los lagos y embalses
Figura 2. Posición de los lagos y embalses (n = 106) en el espacio de componentes principales de los dos primeros ejes de ordenación. SALM: (■) 0,90 – 1,00, (■) 0,40 – 0,89, (o) 0,10 – 0,39, ( ) 0,01 – 0,09
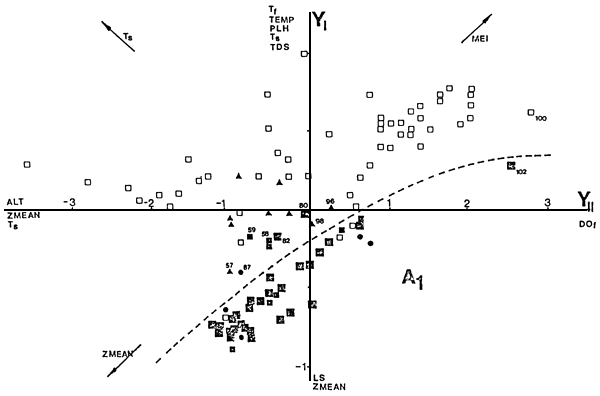
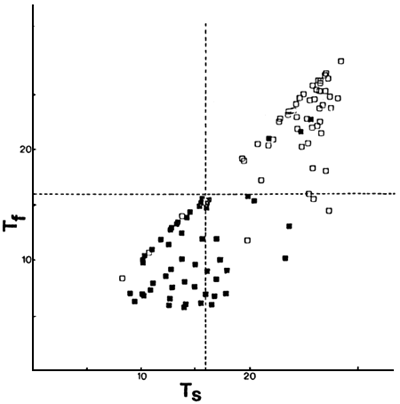
FIGURA 3: Temperatura del agua en el fondo (Tf) versus en superficie (Ts), para n=106 y durante los muestreos.
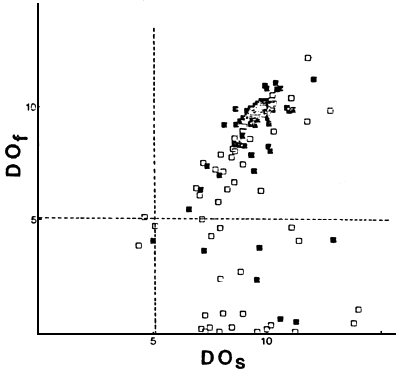
FIGURA 4: Concentración de oxígeno disuelto de fondo (DOf) versus en superficie (DOs), en mg m-3, para n=106 y durante los muestreos.
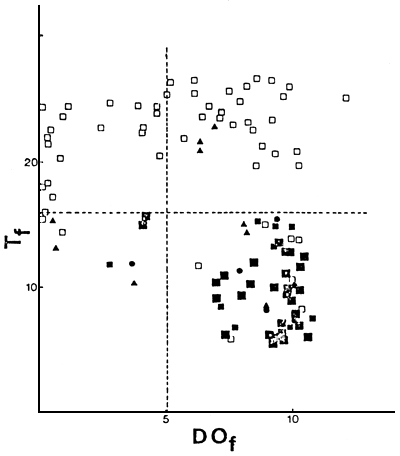
FIGURA 5: Temperatura del fondo (Tf) versus oxígeno disuelto de fondo (DOf), para n=106 y durante los muestreos.