
|
|||||||||
 |
|
||||||||
FAO. 2009. Rana catesbeiana. In Cultured aquatic species fact sheets. Text by Flores Nava, A. Edited and compiled by Valerio Crespi and Michael New. CD-ROM (multilingual).
|
|||||||||
IDENTIDAD
Rasgos biológicos
Una de las ranas más grandes del género Rana; puede alcanzar hasta 20 cm de longitud hocico-cloaca (LHC) y hasta 800 g de peso.
Cuerpo robusto, cabeza ancha y plana. Piel suave y lisa (sin arrugas, verrugas o puntas), color verde pálido dominante con manchas marrones sobre las partes laterales y dorsal del cuerpo, incluyendo miembros y cabeza. Lado abdominal blanco. En machos adultos, el abdomen superior se vuelve temporalmente amarillento al aproximarse la madurez sexual. Miembros anteriores cortos. Patas posteriores robustas y largas (representando hasta 50 por ciento de la longitud total del cuerpo y hasta 40 por ciento del peso total). Tanto los miembros anteriores como posteriores poseen membranas interdigitales. El dimorfismo sexual está presente en esta especie, aunque sólo es visible cuando se alcanza la etapa de pre-adulto.
Cuerpo robusto, cabeza ancha y plana. Piel suave y lisa (sin arrugas, verrugas o puntas), color verde pálido dominante con manchas marrones sobre las partes laterales y dorsal del cuerpo, incluyendo miembros y cabeza. Lado abdominal blanco. En machos adultos, el abdomen superior se vuelve temporalmente amarillento al aproximarse la madurez sexual. Miembros anteriores cortos. Patas posteriores robustas y largas (representando hasta 50 por ciento de la longitud total del cuerpo y hasta 40 por ciento del peso total). Tanto los miembros anteriores como posteriores poseen membranas interdigitales. El dimorfismo sexual está presente en esta especie, aunque sólo es visible cuando se alcanza la etapa de pre-adulto.
Galería de imágenes

Rana catesbeiana |

Corral semi-natural de crianza de rana toro (Brasil Central)
|
|

Corral de crianza con ambiente controlado (Yucatán, México)
|

Tanque de crecimiento, unido a un tanque de crianza de renacuajos (Guatemala) |
PERFIL
Antecedentes históricos
La Rana toro americana es nativa de Norte América. Su distribución geográfica natural se extiende por el norte desde la provincia sureste canadiense de Nuevo Brunswick hacia el sur, a través del este de los Estados Unidos de América, hasta Florida, Alabama y la parte sureste de Texas. Ha sido introducida en numerosas otras regiones, incluyendo América Central y Sur, las Islas del Caribe y el norte y sudeste de Asia.
Los primero intentos documentados para cultivar la rana toro americana se remontan hacia finales del siglo XIX en los Estados Unidos de América. Las granjas primitivas consistían de estanques de tierra cercados, donde se sembraban los renacuajos para que se alimentaran de la productividad natural. Las ranas jóvenes se congregaban a lo largo del borde del estanque, para alimentarse de larvas de insectos eclosionadas desde carne en descomposición u otros desechos de cocina colocados deliberadamente como substratos de desove. Los bajos rendimientos pronto desalentaron tales tentativas pioneras. Hacia fines de los 1930s, las ranas toro fueron introducidas en Brasil y se estableció la primera granja de ranas fuera de los Estados Unidos de América. El éxito fue marginal debido a la falta de suficiente alimento, canibalismo y problemas de enfermedades. El cultivo de ranas toro recuperó popularidad en Brasil hacia mediados de los 1970s. Las empresas pequeñas se multiplicaron y los grupos académicos se involucraron en la investigación hasta fines de los 1980s, desarrollando una gama de diseños de instalaciones y técnicas de cultivo para ranas toro, cuyos sistemas se describen en la sección referente a producción en este documento de información.
En los 1950s, Taiwán Provincia de China, importó el primer grupo de ranas toro como una potencial especie alternativa para la acuicultura. Entonces se estableció un programa de investigación enfocado en el cultivo de Rana catesbeiana.
Los primero intentos para cultivar esta especie en México comenzaron a principios de los 1960s, cuando se introdujo la especie. La primera granja se estableció con el objetivo de satisfacer la demanda creciente de ranas vivas en los Estados Unidos de América. La granja tenía instalaciones de reproducción, crianza de renacuajos y engorde; eventualmente se convirtió en una instalación de producción extensiva de renacuajos para repoblar cuerpos naturales de agua, que más tarde se convirtieron en zonas de captura de ranas.
Entre 1968 y 1990, dos grupos de investigación en los Estados Unidos de América, en la Universidad de Michigan y en la Universidad Estatal de Louisiana, realizaron investigaciones sobre técnicas de cultivo para ranas toro como animales de laboratorio y sobre su fisiología reproductiva, patología y nutrición.
A comienzos de los 1990s, granjeros tailandeses también comenzaron a cultivar ranas y la R. catesbeiana (junto con la Rana tigerina, una especie nativa del Sudeste de Asia) se convirtió en una popular especie de cultivo, con el apoyo técnico de la Universidad Chulalongkorn.
Entre 1991 y 2001, el Centro de Investigación y de Estudios Avanzados (Cinvestav) de México, realizó un extenso programa de investigación aplicada para su cultivo, que resultó en mayores avances en fisiología reproductiva, nutrición, patología y ecofisiología, todo lo cual condujo al desarrollo de un sistema de cultivo de tipo inundado que está actualmente en uso comercial en numerosas regiones de México y América Central.
Los primero intentos documentados para cultivar la rana toro americana se remontan hacia finales del siglo XIX en los Estados Unidos de América. Las granjas primitivas consistían de estanques de tierra cercados, donde se sembraban los renacuajos para que se alimentaran de la productividad natural. Las ranas jóvenes se congregaban a lo largo del borde del estanque, para alimentarse de larvas de insectos eclosionadas desde carne en descomposición u otros desechos de cocina colocados deliberadamente como substratos de desove. Los bajos rendimientos pronto desalentaron tales tentativas pioneras. Hacia fines de los 1930s, las ranas toro fueron introducidas en Brasil y se estableció la primera granja de ranas fuera de los Estados Unidos de América. El éxito fue marginal debido a la falta de suficiente alimento, canibalismo y problemas de enfermedades. El cultivo de ranas toro recuperó popularidad en Brasil hacia mediados de los 1970s. Las empresas pequeñas se multiplicaron y los grupos académicos se involucraron en la investigación hasta fines de los 1980s, desarrollando una gama de diseños de instalaciones y técnicas de cultivo para ranas toro, cuyos sistemas se describen en la sección referente a producción en este documento de información.
En los 1950s, Taiwán Provincia de China, importó el primer grupo de ranas toro como una potencial especie alternativa para la acuicultura. Entonces se estableció un programa de investigación enfocado en el cultivo de Rana catesbeiana.
Los primero intentos para cultivar esta especie en México comenzaron a principios de los 1960s, cuando se introdujo la especie. La primera granja se estableció con el objetivo de satisfacer la demanda creciente de ranas vivas en los Estados Unidos de América. La granja tenía instalaciones de reproducción, crianza de renacuajos y engorde; eventualmente se convirtió en una instalación de producción extensiva de renacuajos para repoblar cuerpos naturales de agua, que más tarde se convirtieron en zonas de captura de ranas.
Entre 1968 y 1990, dos grupos de investigación en los Estados Unidos de América, en la Universidad de Michigan y en la Universidad Estatal de Louisiana, realizaron investigaciones sobre técnicas de cultivo para ranas toro como animales de laboratorio y sobre su fisiología reproductiva, patología y nutrición.
A comienzos de los 1990s, granjeros tailandeses también comenzaron a cultivar ranas y la R. catesbeiana (junto con la Rana tigerina, una especie nativa del Sudeste de Asia) se convirtió en una popular especie de cultivo, con el apoyo técnico de la Universidad Chulalongkorn.
Entre 1991 y 2001, el Centro de Investigación y de Estudios Avanzados (Cinvestav) de México, realizó un extenso programa de investigación aplicada para su cultivo, que resultó en mayores avances en fisiología reproductiva, nutrición, patología y ecofisiología, todo lo cual condujo al desarrollo de un sistema de cultivo de tipo inundado que está actualmente en uso comercial en numerosas regiones de México y América Central.
Principales países productores
Aunque la producción de esta especie sólo la informan a la FAO dos países, también existen granjas comerciales en México, Guatemala, Salvador, Panamá, Ecuador, Argentina, Tailandia, Indonesia, Laos, Vietnam y Malasia, mientras que existen granjas experimentales en los Estados Unidos de América, Cuba y Puerto Rico. Es probable que la producción de las otras granjas comerciales se informe a la FAO bajo la categoría estadística más general 'ranas (Rana spp.)'.
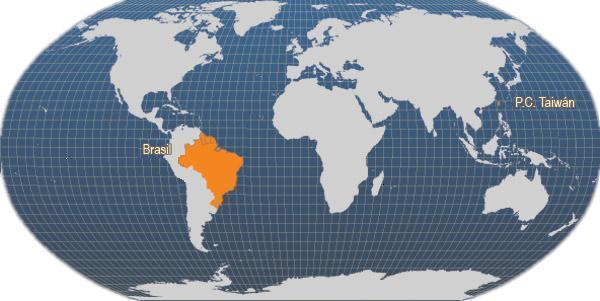
Principales países productores de Rana catesbeiana (FAO Estadísticas pesqueras, 2006)
|
Hábitat y biología
Las ranas toro se adaptan fácilmente a y, ocurren a través de, una amplia gama de condiciones climáticas. Se les encuentra en regiones templadas, donde ellas hibernan para soportar temperaturas ambiente bajo cero y también en regiones tropicales, donde las temperaturas alcanzan 40 °C durante los meses de verano.
La fisiología reproductiva de las ranas toro es altamente influenciada por la temperatura, el fotoperíodo, la humedad ambiente y la presión barométrica. Por lo tanto, mientras más cercana está una población al Ecuador, más amplia es la longitud de su período reproductivo. Si bien es común el desove a lo largo de todo el año en las poblaciones de rana toro de Panamá y Ecuador, las poblaciones silvestres en Mississippi (Estados Unidos de América) tienen una estación reproductiva de tres meses.
La metamorfosis de los renacuajos depende de dos tipos de factores ecológicos:
En general, las ranas toro del hemisferio norte (i.e. Asia, América del Norte y Central) se reproducen desde marzo hasta agosto, mientras que las poblaciones de países al sur del Ecuador (i.e. Brasil, Uruguay y Argentina) se reproducen desde septiembre hasta febrero. La fecundidad de las ranas toro es una función de la edad, más que de la masa corporal. En hembras cultivadas, se han registrado posturas de entre 1 300 y 33 000 huevos para primer desove y hembras de 3 años, respectivamente.
El desarrollo embrionario y la sincronización de la metamorfosis son altamente dependientes de la temperatura. En regiones tropicales (>26 °C) la eclosión ocurre dentro de 48 horas. La concentración de oxígeno disuelto (OD) es de particular importancia en esta etapa, por lo tanto las masas de huevos tienen que ser mantenidas cerca de la superficie. Los niveles de OD deben ser >3 mg/litro. Las larvas recién nacidas tienen aproximadamente 10 mm de longitud y se fijan a superficies por medio de una ventosa oral. Tienen un saco vitelino que se consume en aproximadamente 72 horas a ≥26 °C. Inmediatamente después que se agota el saco vitelino, las larvas se convierten en renacuajos filtradores de vida libre, con actividad natatoria.
La transición ontogenética de los hábitos de alimentación incluye filtrado de fitoplancton, ramoneo de algas bentónicas, detritofagia y un cambio gradual hacia la ingestión de proteína animal, antes de alcanzar el clímax metamórfico cuando la alimentación se hace brevemente autogénica. Después de la reabsorción de la cola, las ranitas se vuelven carnívoras.
Los stocks de ranas cultivadas pueden alcanzar una supervivencia superior al 50 por ciento. La variabilidad genética se expresa a través de una asincronía significativa del crecimiento y del momento de la madurez sexual dentro de cada cohorte. Por lo tanto, bajo condiciones tropicales, los individuos más aptos pueden alcanzar tamaño comercial (>180 g) en 3 meses después de la metamorfosis y la madurez sexual dentro de 7 meses después de eclosionados, mientras que los más débiles pueden demorar un año o más.
La fisiología reproductiva de las ranas toro es altamente influenciada por la temperatura, el fotoperíodo, la humedad ambiente y la presión barométrica. Por lo tanto, mientras más cercana está una población al Ecuador, más amplia es la longitud de su período reproductivo. Si bien es común el desove a lo largo de todo el año en las poblaciones de rana toro de Panamá y Ecuador, las poblaciones silvestres en Mississippi (Estados Unidos de América) tienen una estación reproductiva de tres meses.
La metamorfosis de los renacuajos depende de dos tipos de factores ecológicos:
- Condiciones ambientales adecuadas (temperatura, calidad del agua, disponibilidad de alimento).
- Interacciones competitivas (competencia intra- e inter-específica y presencia de depredadores).
En general, las ranas toro del hemisferio norte (i.e. Asia, América del Norte y Central) se reproducen desde marzo hasta agosto, mientras que las poblaciones de países al sur del Ecuador (i.e. Brasil, Uruguay y Argentina) se reproducen desde septiembre hasta febrero. La fecundidad de las ranas toro es una función de la edad, más que de la masa corporal. En hembras cultivadas, se han registrado posturas de entre 1 300 y 33 000 huevos para primer desove y hembras de 3 años, respectivamente.
El desarrollo embrionario y la sincronización de la metamorfosis son altamente dependientes de la temperatura. En regiones tropicales (>26 °C) la eclosión ocurre dentro de 48 horas. La concentración de oxígeno disuelto (OD) es de particular importancia en esta etapa, por lo tanto las masas de huevos tienen que ser mantenidas cerca de la superficie. Los niveles de OD deben ser >3 mg/litro. Las larvas recién nacidas tienen aproximadamente 10 mm de longitud y se fijan a superficies por medio de una ventosa oral. Tienen un saco vitelino que se consume en aproximadamente 72 horas a ≥26 °C. Inmediatamente después que se agota el saco vitelino, las larvas se convierten en renacuajos filtradores de vida libre, con actividad natatoria.
La transición ontogenética de los hábitos de alimentación incluye filtrado de fitoplancton, ramoneo de algas bentónicas, detritofagia y un cambio gradual hacia la ingestión de proteína animal, antes de alcanzar el clímax metamórfico cuando la alimentación se hace brevemente autogénica. Después de la reabsorción de la cola, las ranitas se vuelven carnívoras.
Los stocks de ranas cultivadas pueden alcanzar una supervivencia superior al 50 por ciento. La variabilidad genética se expresa a través de una asincronía significativa del crecimiento y del momento de la madurez sexual dentro de cada cohorte. Por lo tanto, bajo condiciones tropicales, los individuos más aptos pueden alcanzar tamaño comercial (>180 g) en 3 meses después de la metamorfosis y la madurez sexual dentro de 7 meses después de eclosionados, mientras que los más débiles pueden demorar un año o más.
PRODUCCIÓN
Ciclo de producción

Ciclo de producción de Rana catesbeiana
Sistemas de producción
Suministro de semilla
Los cultivadores de rana toro emplean diversas estrategias para obtener semilla. Éstas incluyen la recolección de masas de huevos o renacuajos desde la naturaleza, así como reproducción semi-natural en cautiverio (reproducción semi-controlada) y, más recientemente, manipulación ambiental y hormonal para la reproducción controlada.
Recolección desde la naturaleza
Muchos pequeños cultivadores de América latina recolectan renacuajos durante la estación reproductiva, en áreas donde ocurren poblaciones silvestres de rana toro. Los renacuajos más pequeños (<50 mm) son transportados en bolsas plásticas con agua saturada de oxígeno en densidades de 1 500-2 000/litro. Los renacuajos en proceso de metamorfosis también se recolectan. Éstos se colocan sobre láminas de algodón empapadas y se transportan in cajas de cartón perforadas en densidades de 250/m2 del área del fondo de la caja.
Reproducción semi-natural
Esto consiste en colocar ranas adultas, machos y hembras, en corrales de reproducción donde prácticamente no se realiza manejo, a excepción de la alimentación. Los corrales de reproducción son de dos tipos. Los cultivadores asiáticos emplean tanques cuadrados de concreto de 10-20 m2, con paredes de 1 m de alto y una capa permanente de agua de 8-12 cm. El agua fluye a través del tanque continuamente. Los reproductores se colocan en densidades de 1-5/m2 y una proporción sexual de 1 macho:1-3 hembras. La alimentación consiste en pellets flotantes con 40 por ciento de proteína, proporcionados una vez al día a razón de 2,5-3 por ciento del peso corporal /día.Los criaderos de rana toro en América latina generalmente emplean un tipo de corral de reproducción semi-seco. Éste consiste en un área de dimensiones variables (abarcan desde 10 a 1 600 m2), construido de ladrillos o bloques y cubierto con tejido agrícola para sombreado. Algunos corrales también tienen una malla superior para evitar la depredación por aves. Entre 75 y 90 por ciento del área total de superficie del piso del corral está cubierta de pasto, mientras que el resto tiene charcos someros (<10 cm) revestidos de hormigón. Estos últimos se utilizan como sitios de desove y pueden ser pequeños (1 m2), para un par de reproductores a la vez, o suficientemente grandes para reproducción colectiva (20-60 m2). También están presentes puntos de alimentación y refugios. La alimentación consiste en pellets de un 40 por ciento de proteína, distribuidos una vez al día a razón de 2,5-3 por ciento del peso corporal /día, junto con larvas de mosca (Musca domestica) a razón de 2-3 por ciento del peso corporal/día.
Reproducción controlada
La reproducción controlada implica la manipulación de la temperatura ambiental y del agua, la humedad ambiente y el fotoperíodo en instalaciones de crianza cubiertas. Tales estrategias son generalmente suficientes para estimular la reproducción a través del año, especialmente en latitudes térmicamente estables. Sin embargo, la estimulación hormonal se emplea ocasionalmente. Los criaderos intensivos de rana toro en México y Guatemala emplean instalaciones de crianza cubiertas, las cuales retienen el calor por un efecto invernadero. Los edificios se dividen en tres secciones:
- Una serie de 3-5 tanques de 25 m2, para mantener los reproductores separados por sexo.
- Un área colectiva de reunión para machos y hembras.
- Una serie de pequeños (1 m2) charcos para el desove.
Incubación
La mayoría de las granjas utilizan sus tanques de cría de renacuajos para incubar los desoves fertilizados. Sin embargo, algunas otras tienen instalaciones específicas para incubación. Éstas involucran edificios de hormigón donde se colocan los huevos en pequeños (1 m2) recipientes de plástico o fibra de vidrio. Los huevos fertilizados se mantienen en un lugar sombreado y ventilado (25-26 °C), poco profundo (5-8 cm), estático, libre de cloro, con una capa de agua limpia. No se emplea aireación. La eclosión ocurre dentro de 48 horas a 26 °C.
Criadero
Crianza de renacuajos
Una vez que los renacuajos alcanzan la etapa de primera alimentación, se les transfiere a los tanques de crianza de renacuajos. En las primeras dos semanas se realiza inoculación del fitoplancton y luego se proporciona alimentación suplementaria 2-4 veces al día. La densidad de siembra recomendada es 50/m2.
La calidad del agua se mantiene haciendo correr agua dulce continuamente a través del tanque (1-1,5 veces/día), o con aireación. La selección y el raleo son procedimientos rutinarios para bajar la competencia intra-específica. El momento de la metamorfosis varía grandemente entre individuos. Los renacuajos precoces se convierten en ranitas en 45 días, mientras que la mayoría de la población alcanza aquello en 90-120 días y una porción pequeña de la cohorte (7-12 por ciento) se transformará después de un año o más, incluso en condiciones tropicales.
Crecimiento
Los tanques de crecimiento se utilizan solamente en el sistema mojado mexicano. Dichos tanques tienen 5,0 x 2,5 x 0,40 m y están unidos a los tanques de crianza de renacuajos (ver fotografía en la galería de imágenes). Aquí a las ranitas se les adiestra para que se alimenten de pellets inertes, flotantes. A través de selección y raleo rutinarios, se elimina a los individuos más débiles, de crecimiento lento. Las ranitas se siembran a razón de entre 50 y 75/m2. Permanentemente, se mantiene una capa de agua de 2 cm. Las ranas jóvenes son alimentadas ad libitum al menos 6 veces al día con desmenuzados flotantes de 1/16" [1,6 mm], conteniendo 40 por ciento de proteína cruda, hasta que alcanzan 30-45 g, lo cual normalmente demora entre 30 y 45 días a 26 °C.
Técnicas de engorda
Los sistemas de engorde se pueden clasificar en dos tipos principales: sistemas secos y semi-secos o mojados (inundados).
Sistemas secos
Éstos incluyen los diseños brasileños mencionados en la tabla siguiente.
| Sistema | Principales características físicas | Países |
| Aquaterrarium | Canales abiertos de tierra u hormigón, poco profundos, estrechos, largos con las orillas y terrazas inclinadas y cubiertas de hierbas | Brasil, México |
| Tanque-Isla | Tanque cuadrado de 20-30 m2, amurallado, sin techo, piso cubierto de hierbas, con una plataforma central de hormigón (10 por ciento del área superficial), rodeada por un canal bajo (<0,10 m) | Brasil, Taiwán Provincia de China |
| Salas de Confinamiento | Salas cuadradas de 12 m2, amuralladas, con piso de hormigón. El piso es una rampa con su parte más inferior bajo una capa de agua y techada | Brasil |
| Amphifarm | Edificios cerrados de hormigón, que contienen 8-12 salas de crecimiento de 20-25 m2, con piso de hormigón. El piso tiene dos canales estrechos, refugios prefabricados y bateas de alimentación | Brasil, Ecuador |
| Invernaderos | Tanques de madera u hormigón de 4-8 m2, con el piso parcialmente inundado. Los tanques se colocan en un edificio con estructura de madera o metal, techado con plástico o lona | Brasil, Argentina, Uruguay, México, Guatemala |
| Ranabox | Conjunto vertical de cajas calentadas, de madera o fibra de vidrio, con agua y bandejas de alimentación | Brasil, Argentina |
Sistemas semi-secos y mojados
Esta categoría abarca un número de sistemas empleados en el sudeste de Asia, así como algunas versiones latinoamericanas empleadas en México, Guatemala, Argentina y Uruguay. La tabla siguiente resume las principales características operacionales y productivas.
| Sistema | Principales características físicas | Países |
| Área superficial mojada | 30-50 % del área total del piso del tanque de engorde | 100 % del área total del piso del tanque de engorde |
| Dinámica hídrica | Estática | Agua corriente |
| Etapa de crecimiento | No | Sí |
| Producción promedio | 12-16 kg/m2 | 14-22 kg/m2 |
| Tipo de alimento | Suplementario + vivo (larvas de mosca) | 100% alimentos suplementario |
| Versatilidad funcional | Limitada | Alta |
Suministro de alimento
En algunos países asiáticos se utiliza alimento específico para ranas, mientras que los cultivadores latinoamericanos emplean principalmente alimentos para tilapia o trucha.
Técnicas de cosecha
Una vez que las ranas alcanzan el tamaño comercial, se les prepara para la cosecha. Las ranas son hambreadas por 24 hrs antes de la cosecha. En los sistemas semi-secos, las salas de engorde se drenan y las ranas se recogen manualmente. En los sistemas mojados, la cosecha se realiza más o menos de la misma manera aunque, en algunas granjas, se bombea agua helada en los tanques para anestesiar a las ranas por hipotermia y permitir una mejor manipulación.
Manipulaci�n y procesamiento
El procesamiento de las ranas se realiza en instalaciones de proceso certificadas. Las ranas se anestesian por hipotermia (12´ a 4 °C) y luego se sacrifican. El procesamiento incluye el desangrado, despellejado y corte de los miembros inferiores, los cuales se limpian luego cuidadosamente usando agua tratada con cloro. Después las piernas se embolsan individualmente, se congelan y se embalan por tamaños en cajas especiales para transporte. Las ancas de rana se mantienen congeladas a -15±2 °C lo cual les otorga una vida útil de hasta 6 meses.
Las ranas para los mercados vivo o científico se enjuagan y embalan manualmente en cajas perforadas de cartón encerado de 25 lb [11,34 kg]. Las ranas vivas se transportan por avión en condiciones de ambiente fresco y seco. La sobrevivencia generalmente es de hasta 99 por ciento cuando el viaje no excede las 72 hrs.
Costos de producción
Se ha informado que los costos anuales de operación de una granja de rana toro de 36 toneladas/año (en México) totalizan 67 560 USD (41 por ciento alimento; 31 por ciento mano de obra). Los costos fijos de inversión fueron 130 000 USD (terreno 20 000 USD; infraestructura 90 000 USD; equipamiento 16 000 USD y stock inicial de reproductores 4 000 USD).
Enfermedades y medidas de control
Los principales problemas de enfermedades que afectan a la rana toro americana se incluyen en la tabla abajo.
En algunos casos se ha utilizado antibióticos y otros productos farmacéuticos en el tratamiento, pero su inclusión en esta tabla no implica una recomendación de la FAO.
Proveedores con experiencia en patología
Se puede obtener asistencia de las siguientes fuentes:
En algunos casos se ha utilizado antibióticos y otros productos farmacéuticos en el tratamiento, pero su inclusión en esta tabla no implica una recomendación de la FAO.
| ENFERMEDAD | AGENTE | TIPO | SINDROME | MEDIDAS |
| Enfermedad de la 'pierna roja' | Ocurrencia de diversas bacterias, ya sea de manera sinérgica o mono-específica. Los géneros más comunes son Aeromonas, Pseudomonas, Klebsiella, Edwardsiella, Myma, Streptococcus | Bacterias | Piernas rojas; ano rojo | Antibióticos; bioseguridad; movimiento solamente de los organismos no infectados |
| Edema general | Los géneros causativos más comunes son Streptococcus and Staphylococcus | Bacterias | Hinchazón general | Antibióticos; bioseguridad; movimiento solamente de los organismos no infectados |
| Enfermedad 'del remolino' | Los géneros más comúnmente encontrados en los organismos enfermos son Aeromonas, Streptococcus and Staphylococcus | Bacterias | – | Antibióticos; bioseguridad; movimiento solamente de los organismos no infectados |
| Tuberculosis | Mycobacterium spp. | Bacteria | Tuberculosis; pueden aparecer úlceras superficiales | Antibióticos; bioseguridad; movimiento solamente de los organismos no infectados |
| Micosis | Achlya spp., Saprolegnia spp. | Hongos | Úlceras, a veces con micelios visibles; enrojecimiento de la piel | Fungicidas; bioseguridad |
| Ambiental | Diversos (congénitos, nutricionales, ambientales) | – | – | Buenas prácticas de manejo |
Proveedores con experiencia en patología
Se puede obtener asistencia de las siguientes fuentes:
ESTADÍSTICAS
Estadísticas de producción
|
Producción de acuicultura global de Rana catesbeiana
(FAO Estadísticas pesqueras)  |
|
Mercado y comercio
En 1980, se estimó que el 3 por ciento del mercado global de ranas (todas las especies) era abastecido por la acuicultura, mientras que la contribución actual (2002) estimada es de 15 por ciento, tomando en cuenta la tasa calculada de crecimiento de la industria.
Las estadísticas del mercado de ranas son escasas y poco confiables. Algunas estadísticas documentadas de la demanda colocan a los Estados Unidos de América como el mayor consumidor de ranas (todas las especies), seguido por Francia, Canadá, Bélgica, Italia y España.
Hay tres nichos principales de mercado para la rana toro americana, a saber:
La demanda de ranas vivas para alimento ha aumentado especialmente entre grupos asiáticos que viven en Canadá y los Estados Unidos de América. Los precios al por mayor fluctúan entre 2,25 y 3,75 USD/kg de rana entera, dependiendo del peso. Los principales productores de ranas vivas (captura y acuicultura) son Taiwán, Brasil y México.
En los Estados Unidos de América, las ranas toro vivas para propósitos educativos o científicos se venden a compañías que las procesan. Se comercializan tres categorías de tamaño: 4-5" [10,2-12,7 cm], 5-6" [12,7-15,2 cm] y 6-7" [15,2-17,8 cm] (LHC); los precios abarcan desde 1,30 a 3,25 USD cada una.
Las estadísticas del mercado de ranas son escasas y poco confiables. Algunas estadísticas documentadas de la demanda colocan a los Estados Unidos de América como el mayor consumidor de ranas (todas las especies), seguido por Francia, Canadá, Bélgica, Italia y España.
Hay tres nichos principales de mercado para la rana toro americana, a saber:
- Ancas de rana.
- Ranas vivas.
- Ranas para necesidades educativas y científicas.
La demanda de ranas vivas para alimento ha aumentado especialmente entre grupos asiáticos que viven en Canadá y los Estados Unidos de América. Los precios al por mayor fluctúan entre 2,25 y 3,75 USD/kg de rana entera, dependiendo del peso. Los principales productores de ranas vivas (captura y acuicultura) son Taiwán, Brasil y México.
En los Estados Unidos de América, las ranas toro vivas para propósitos educativos o científicos se venden a compañías que las procesan. Se comercializan tres categorías de tamaño: 4-5" [10,2-12,7 cm], 5-6" [12,7-15,2 cm] y 6-7" [15,2-17,8 cm] (LHC); los precios abarcan desde 1,30 a 3,25 USD cada una.
ESTATUS Y TENDENCIAS
Se espera que los esfuerzos continuados de investigación sobre nutrición, patología y reproducción den lugar a mejoras importantes que impulsarán la producción en el futuro. Sin embargo, todavía hay mucho por hacer en genética. Respecto al mercado, los precios tenderán a aumentar gradualmente, en la medida que se restringe el comercio y captura de ranas silvestres, siendo así substituidas por animales cultivados; no obstante, deben realizarse esfuerzos importantes en la comercialización y la publicidad, puesto que la carne de rana y sus cualidades están lejos de ser extensamente conocidas.
PRINCIPALES ASUNTOS
Como en cualquier otro tipo de acuicultura, el cultivo de rana toro puede causar problemas si no se maneja correctamente. La tabla siguiente resume una serie de externalidades que son probables de generarse por el cultivo de ranas, así como los riesgos involucrados y algunas sugerencias para su prevención o mitigación.
| Externalidades | Riesgos | Estrategias de mitigación |
| Descargas orgánicas | Eutrofización y alteración ecológica de las aguas circundantes; contaminación orgánica del agua usada para consumo humano | Tratamiento de las aguas residuales en la granja; reutilizar las aguas residuales en agricultura; usar alimentos que generan baja contaminación |
| Liberación de antibióticos | Estimulación de la resistencia bacteriana natural | Desincentivar el uso de antibióticos; sustituir las drogas por manejo y profilaxis eficientes |
| Introducción de especies exóticas | Introducción de patógeno no nativos; desplazamiento competitivo de las especies locales; hibridación indeseada | Implementar estudios preliminares de impacto ecológico; adoptar medidas estrictas de bio-seguridad para evitar/prevenir los escapes; poner en cuarentena a los organismos introducidos |
| Conflictos de uso de recursos | Agua o tierra que son usadas, o se pueden utilizar, de una manera más eficiente para generar más beneficios sociales | Hacer un análisis costo/beneficio comparativo con otras actividades económicas o sociales potenciales o ya en ejecución |
| Recolección de huevos y renacuajos del medio natural | Disminuye el reclutamiento para la pesquería de ranas comercialmente importantes | Realizar estudios de dinámica poblacional; utilizar la acuicultura para repoblar las zonas naturales de extracción/pesca |
Prácticas de acuicultura responsable
Todos los países solicitan certificación sanitaria al comprar ancas de rana, pero no se requiere ningún papeleo CITES.
Es importante desarrollar marcos reguladores específicos para el cultivo de rana toro, ya que se está convirtiendo en una importante actividad de acuicultura en muchas regiones. También se debe seguir los principios generales adoptados por el Código de Conducta para la Pesca Responsable, Artículo 9.
Es importante desarrollar marcos reguladores específicos para el cultivo de rana toro, ya que se está convirtiendo en una importante actividad de acuicultura en muchas regiones. También se debe seguir los principios generales adoptados por el Código de Conducta para la Pesca Responsable, Artículo 9.
REFERENCIAS
Bibliografía
|
Aguiar, H. 1992. O sistema vertical ranabox. In Anais do VII Encontro Nacional de Ranicultores. Rio de Janeiro, Brazil, avril 6-9, 1992, pp. 65-70. Associa��o dos Ranicultores de Rio de Janeiro. Benitez, M.M. & Flores-Nava, A. 1997. Growth and metamorphosis of Rana catesbeiana (Shaw) tadpoles fed live and supplementary feed, using tilapia Oreochromis niloticus (L.) as a biofertilizer. Aquaculture Research, 28:481-488. Carmona, C., Olvera, M.A., Flores-Nava y V. & Ontiveros, A. 1997. La nutrici�n de la rana y su importancia en ranicultura. In Mem. II Technofrog �97. International Meeting on Frog Research and Technology. Santos, Brazil, July 19-23, 1997, pp. 75-81. Academia Brasileira de Estudos Tecnicos em Ranicultura. Chamberlain, F.M. 1897. Notes on the edible frogs of the United States and their artificial propagation. US Bureau of Fisheries. Fisheries Document for 1897. pp. 249-261. Washington, DC, USA. Chen, T.P. 1976. Aquaculture Practices in Taiwan. Page Bros, Norwich, UK. 162 pp. Culley, D.D. 1976. Culture and management of the laboratory frog. Laboratory Animal, 5:30-36. Culley, D.D. 1991. Bullfrog culture. In C.E. Nash (ed.), Production of Aquatic Animals. World Animal Science C4, pp. 185-205. Elsevier, Amsterdam, Netherlands. Culley, D.D., Horseman, N.D., Amborski, R.L. & Meyers, S.P. 1978. Current status of amphibian culture with emphasis on nutrition, diseases and reproduction of the bullfrog Rana catesbeiana. Proceedings of the World Mariculture Society, 9:653-670. Donizete, T.R. 1997. Avalia�ao do Mercado mundial de carne de rana. In Mem. II Technofrog �97. International Meeting on Frog Research and Technology. Santos, Brazil, July 19-23, 1997, pp. 3-11. Academia Brasileira de Estudos Tecnicos em Ranicultura. Easley, K.A., Culley, D.D., Horseman, N.D. & Penkala, J.E. 1979. Environmental influences in hormonally induced spermiation of the bullfrog Rana catesbeiana. Journal of Experimental Zoology, 207:407-416. Flores-Nava, A. 1992. Specific phytoplankton consumption rates and preferences by tadpoles of the bullfrog Rana catesbeiana fed a polyculture of microalgae. In Abstracts of World Aquaculture �92, Orlando, Florida, May 21-25, 1992, pp. 139-140. World Aquaculture Society, Baton Rouge, Louisiana, USA. Flores-Nava, A. 1993. Avances en la investigaci�n y desarrollo de la tecnolog�a del cultivo de rana en el sureste de M�xico. In Mem. I Simposio Internacional de Investigaci�n Acu�cola en Centroam�rica. San Jos�, Costa Rica, octubre 5-8, 1993, pp. 99-106. Universidad Nacional de Costa Rica. Imprenta Universitaria, San Jose, Costa Rica. Flores-Nava, A. 1994. An overview of frog farming in M�xico. In K.P.P. Nambiar & T. Singh (eds.). Proceedings of the INFOFISH-AQUATECH �94 International Conference on Aquaculture, Colombo, Sri Lanka, August 29-31, 1994, pp. 131-137. INFOFISH, Kuala Lumpur, Malaysia. Flores-Nava, A. 1999. Cultivo Intensivo de Rana Toro Rana catesbeiana. Manual. T�cnicas de Acuicultura. Programa Regional de Apoyo al Desarrollo de la Pesca en el Istmo Centroamericano (PRADEPESCA-Uni�n Europea). Panama. 42 pp. Flores-Nava, A. & Vera, P. 1999. Growth, metamorphosis and feeding behavior of Rana catesbeiana Shaw, 1802 tadpoles at different rearing densities. Aquaculture Research, 30:1-7. Flores-Nava, A. 2000. Frog farming: a comparison between the wet and the semi-dry on-growing systems. Global Aquaculture Advocate, 1(1):52-54. Flores-Nava, A. 2001a. Aspectos generales de la biolog�a de Rana catesbeiana de importancia para su cultivo. In T. Jaramillo, Olivera, J. & Vel�zquez, J. (eds.), Reproducci�n y Manejo de Fauna Silvestre, pp. 195-210. Universidad Aut�noma Metropolitana, M�xico, Distrito Federal, Mexico. Flores-Nava, A. 2001b. Generalidades del cultivo de rana toro Rana catesbeiana, Shaw, 1802. In T. Jaramillo, Olivera, J. & Vel�zquez, J. (eds.), Reproducci�n y Manejo de Fauna Silvestre, pp. 211-233. Universidad Aut�noma Metropolitana, M�xico, Distrito Federal, Mexico. Flores-Nava, A. 2002. Estudio de factibilidad para el establecimiento de una granja de rana para el mercado exterior, en Panama. Documento de Circulaci�n Restringida. Convenio HO/AFN 0125-2002. Grupo HO-Panama, Panam�. 33 pp. Fontanello, D., Arruda-Soares, H., Mandelli, J., Penteado, L.A. & Justo, C.L. 1984. In Manejo Alimentar de Ras. Mem. IV Encontro Nacional de Ranicultores. Goiania, Brazil, 5-9 novembro, 1984, pp. 91-107. Mim. Associa��o Goiania dos Criadores de Ras. Glorioso, J.C., Amborski, R.L., Amborski, G.F. & Culley, D.D. 1974. Microbiological studies on septicemic bullfrogs, Rana catesbeiana. American Journal of Veterinary Research, 35:1241-1245. Gosner, K.L. 1960. A simplified table for staging anuran embryos and larvae with notes on identification. Herpetologica Chicago, 16:183-190. Horseman, N.D., Smith, C.A. & Culley, D.D. 1978. Effects of age and photoperiod on ovary size and condition in the bullfrog (Rana catesbeiana Shaw) (Amphibia, Anura, Ranidae). Journal of Herpetology, 12(3):287-290. Lindenbaum, I. 1997. Estad�sticas de comercio exterior: Mercado de ancas de rana en USA y Francia. In Proceedings of the II Technofrog �97. International Meeting on Frog Research and Technology. Santos, Brazil, July 19-23, 1997, pp. 26-38. Academia Brasileira de Estudos Tecnicos en Ranicultura. Lopes-Lima, S. & Agostinho, C.A. 1988. A cria�ao de ras. Editorial Globo (Cole�ao do agricultor-pequenos animais), Rio de Janeiro, Brazil. 187 pp. Lopes-Lima, S. & Agostinho, C.A. 1992. A tecnolog�a de cria�ao de ras. Universidade Federal de Vi�osa. Imprenta Universitaria, Vi�osa, Minas Gerais, Brazil. 168 pp. Mayes, I. 1963. Folleto instructivo para la cr�a artificial de la rana comestible rana toro Rana catesbeiana. Bolet�n del Banco Nacional de Cr�dito Ejidal, Oficina de Piscicultura, Distrito Federal, M�xico. 47 pp. Nace, G.W. 1968. The amphibian facility of the University of Michigan. Bioscience, 18:767-775. Oloriz, M. 1997. La ranicultura en Uruguay: desarrollo y perspectivas. In Proceedings II Technofrog '97. International Meeting on Frog Research and Technology. July 19�23. Santos, Brazil, p. 8. Academia Brasileira de Estudos Tecnicos em Ranicultura. Ontiveros, E.V., Valdez, R.A., Lili, A., Romano, M. & Flores-Nava, A.2002a. Influencia ambiental sobre el sistema end�crino-reproductivo, maduraci�n gon�dica y desoves en hembras de Rana catesbeiana, Shaw, 1802. In Memorias de la. XXVII Reuni�n Anual de la Academia de Investigaci�n en la Reproducci�n, A.C. Morelia, Mich., M�xico, jul. 1�3, 2002, p. 250. Academia de Investigaci�n en la Reproducci�n, A.C., Mexico, Distrito Federal. Ontiveros, V., Flores-Nava, A., Orozco, H., Lili, A., Navarro, M.C. & Ambriz, G. 2002b. Estimaci�n del n�mero de espermatozoides en test�culos, a partir de la masa corporal en rana toro Rana catesbeiana Shaw, 1802. In Memorias de la VII Reuni�n Nacional de Herpetolog�a. Guanajuato, M�xico, nov. 25-28, 2002, p. 122. Sociedad. Mexicana de Herpetolog�a. Paryanonth, P. & Daorerk, V. 1994. Frog farming in Thailand. In K.P.P. Nambiar & T. Singh (eds.). Proceedings of the INFOFISH-AQUATECH �94 International Conference on Aquaculture, Colombo, Sri Lanka, August 29-31, 1994, pp. 126-130. INFOFISH, Kuala Lumpur, Malaysia. Rubin, R. 1979. La rana y su Explotaci�n. Editorial Continental, M�xico, Distrito Federal. 132 pp. Ryan, M.J. 1980. The reproductive behavior of the bullfrog Rana catesbeiana. Copeia, 1:108-114. Santana-Costa.1992. Desenvolvimento do aparelho reprodutor e fatores associados ao ciclo reproductivo da ra-touro no sistema anfigranja. Unpublished MSc Thesis. Universidade Federal de Vi�osa, Mina Gerais, Brazil. 98 pp. Vizotto, L.D. 1979. Aspectos t�cnicos de ranicultura. In Anais de I Encontro Nacional de Ranicultura. Mimiog. Universidade de Sao Paulo, Brazil, jan. 12�15, 1979, pp. 27-67. Universidade de S�o Paulo, Brasil. |
