IDENTIDAD
Rasgos biológicos
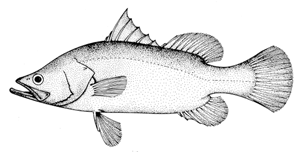
Cuerpo elongado, comprimido, con un pronunciado pedúnculo caudal. Cabeza puntiaguda, con el perfil dorsal cóncavo volviéndose convexo al frente de la aleta dorsal. Boca grande, ligeramente oblicua, mandíbula superior llegando hasta detrás del ojo; dientes viliformes, sin caninos. Parte baja del pre-opérculo con una espina fuerte; opérculo con espina pequeña y una solapa serrada sobre el origen de la línea lateral. El primer arco branquial tiene de 16 a 17 lamelas branquiales. Grandes escamas ctenoideas. Aleta dorsal con 7 a 9 espinas y 10 a 11 rayos suaves; muesca profunda en la aleta, casi dividiendo la parte espinosa de la suave; aleta pectoral corta y redondeada, sierras cortas y fuertes encimasobre su base; aletas dorsal y anal con vainas escamosas. Aleta anal redondeada, con 3 espinas y de 7 a 8 rayos suaves. Aleta caudal redondeada. Color en dos fases, ya sea café-verde olivo arriba con costados y abdomen plateados (normalmente en juveniles) o verde/ azul arriba con inferior plateado. No hay manchas o barras en las aletas o cuerpo.
Galería de imágenes

Producción a gran escala de perca gigante (Darwin, Northern Territory, Australia)
|

Granja de jaulas marinas en Hong Kong SAR, China
|
|

Granja de engorda en jaulas (Australia)
|

Cabeza de perca gigante
|
PERFIL
Antecedentes históricos
Lates calcarifer, conocido como lubina en Asia y perca gigante en Australia, es un miembro grande y eurihalino de la familia de Centropomidae, distribuido en la región del Pacífico indo-occidental, desde el Golfo Arábigo hasta China, la Provincia China de Taiwán, Papua Nueva Guinea y el norte de Australia. La acuicultura de esta especie comenzó en los 70 en Tailandia y se expandió rápidamente a través del sudeste asiático.
Entre los atributos que hacen de la perca gigante un candidato ideal para la acuicultura están:
Australia experimenta el desarrollo de grandes granjas de perca gigante que reflejan el estilo industrializado de acuicultura que se vive en Europa. En aquellos países donde se cultiva la perca gigante fuera de los trópicos, se utilizan sistemas de producción por recirculación (e.g. en el sur de Australia y en los estados del noreste de Estados Unidos).
La perca gigante se ha introducido para su cultivo a Irán, Guam, la Polinesia Francesa, Estados Unidos (Hawaii, Massachusetts) e Israel.
Entre los atributos que hacen de la perca gigante un candidato ideal para la acuicultura están:
- Es una especie resistente que tolera altas densidades y soporta grandes tolerancias fisiológicas.
- La alta fecundidad de las hembras provee abundante material para la producción de semilla en criaderos.
- La producción de semilla en criaderos es relativamente simple.
- La perca gigante puede alimentarse con alimentos peletizados y los juveniles se adaptan bien a las condiciones de cautiverio.
- La perca gigante crece rápidamente, alcanzando una talla comercial (350 g – 3 kg) entre seis meses y dos años.
Australia experimenta el desarrollo de grandes granjas de perca gigante que reflejan el estilo industrializado de acuicultura que se vive en Europa. En aquellos países donde se cultiva la perca gigante fuera de los trópicos, se utilizan sistemas de producción por recirculación (e.g. en el sur de Australia y en los estados del noreste de Estados Unidos).
La perca gigante se ha introducido para su cultivo a Irán, Guam, la Polinesia Francesa, Estados Unidos (Hawaii, Massachusetts) e Israel.
Principales países productores
A pesar de que se ha introducido para su cultivo a varios países, tal como se mencionó en la sección anterior, los únicos países que han reportado producción a la FAO son los que aparecen en el mapa.

Principales países productores de Lates calcarifer (FAO Estadísticas pesqueras, 2006)
|
Hábitat y biología
La perca gigante habita aguas dulces, salobres y marinas, incluyendo arroyos, lagos, bahías (billabongs), estuarios y aguas costeras. La perca gigante es un depredador oportunista; en su dieta de adulto predominan los crustáceos y peces.
La estacionalidad del desove varía dentro del rango de distribución de la especie. En el norte de Australia, la perca gigante desova entre septiembre y marzo, con variaciones latitudinales en la temporada de desove, generalmente como respuesta a la variación en la temperatura del agua. En las Filipinas, la perca gigante desova de fines de junio a fines de octubre, mientras que en Tailandia el desove se asocial con la temporada de monsón, con dos picos durante el monsón del noreste (agosto-octubre) y el monsón del sureste (febrero-junio). El desove se lleva a cabo cerca de la boca de los ríos, en las partes bajas de los estuarios y cerca de las entradas costeras. La perca gigante desova después de las lunas llena y nueva y su actividad está relacionada con las mareas entrantes que aparentemente asisten en el transporte de los huevos y las larvas a los estuarios.
La perca gigante es muy fecunda; una sola hembra (120 cm LT) puede producir de 30 a 40 millones de huevos. En consecuencia, solo se requieren pequeñas cantidades de pies de cría para proveer cantidades adecuadas de larvas para la producción en criaderos a gran escala.
El reclutamiento de larvas ocurre en aguas estuarinas o pantanos, en donde permanecen por varios meces antes de mudarse a los afluentes de agua dulce de ríos costeros y riachuelos. Los juveniles de perca gigante permanecen en hábitats de agua dulce hasta que alcanzan los tres o cuatro años (60–70 cm LT) cuando llegan a la madurez sexual como machos y luego nadan aguas abajo durante la temporada de reproducción para participar en el desove. Puesto que la perca gigante es eurihalina, puede cultivarse en un amplio rango de salinidades, desde agua dulce hasta agua salada. Cuando tiene entre seis y ocho años (85–100 cm LT), la perca gigante australiana cambia de sexo a hembra y permanece como tal el resto de su vida. El cambio de sexo en las poblaciones asiáticas está menos definido y las hembras primarias son comunes.
Aunque se ha registrado que algunas percas gigantes se mueven extensivamente entre sistemas fluviales, la mayoría permanecen en el sistema de donde son oriundas y recorren pequeñas distancias. Este limitado intercambio de individuos entre sistemas fluviales es un factor que ha contribuido al desarrollo de grupos genéticamente distintos de perca gigante en el norte de Australia, donde existen seis cepas genéticas identificadas en Queensland, y otras diez en el Territorio del Norte y Australia Occidental.
La estacionalidad del desove varía dentro del rango de distribución de la especie. En el norte de Australia, la perca gigante desova entre septiembre y marzo, con variaciones latitudinales en la temporada de desove, generalmente como respuesta a la variación en la temperatura del agua. En las Filipinas, la perca gigante desova de fines de junio a fines de octubre, mientras que en Tailandia el desove se asocial con la temporada de monsón, con dos picos durante el monsón del noreste (agosto-octubre) y el monsón del sureste (febrero-junio). El desove se lleva a cabo cerca de la boca de los ríos, en las partes bajas de los estuarios y cerca de las entradas costeras. La perca gigante desova después de las lunas llena y nueva y su actividad está relacionada con las mareas entrantes que aparentemente asisten en el transporte de los huevos y las larvas a los estuarios.
La perca gigante es muy fecunda; una sola hembra (120 cm LT) puede producir de 30 a 40 millones de huevos. En consecuencia, solo se requieren pequeñas cantidades de pies de cría para proveer cantidades adecuadas de larvas para la producción en criaderos a gran escala.
El reclutamiento de larvas ocurre en aguas estuarinas o pantanos, en donde permanecen por varios meces antes de mudarse a los afluentes de agua dulce de ríos costeros y riachuelos. Los juveniles de perca gigante permanecen en hábitats de agua dulce hasta que alcanzan los tres o cuatro años (60–70 cm LT) cuando llegan a la madurez sexual como machos y luego nadan aguas abajo durante la temporada de reproducción para participar en el desove. Puesto que la perca gigante es eurihalina, puede cultivarse en un amplio rango de salinidades, desde agua dulce hasta agua salada. Cuando tiene entre seis y ocho años (85–100 cm LT), la perca gigante australiana cambia de sexo a hembra y permanece como tal el resto de su vida. El cambio de sexo en las poblaciones asiáticas está menos definido y las hembras primarias son comunes.
Aunque se ha registrado que algunas percas gigantes se mueven extensivamente entre sistemas fluviales, la mayoría permanecen en el sistema de donde son oriundas y recorren pequeñas distancias. Este limitado intercambio de individuos entre sistemas fluviales es un factor que ha contribuido al desarrollo de grupos genéticamente distintos de perca gigante en el norte de Australia, donde existen seis cepas genéticas identificadas en Queensland, y otras diez en el Territorio del Norte y Australia Occidental.
PRODUCCIÓN
Ciclo de producción
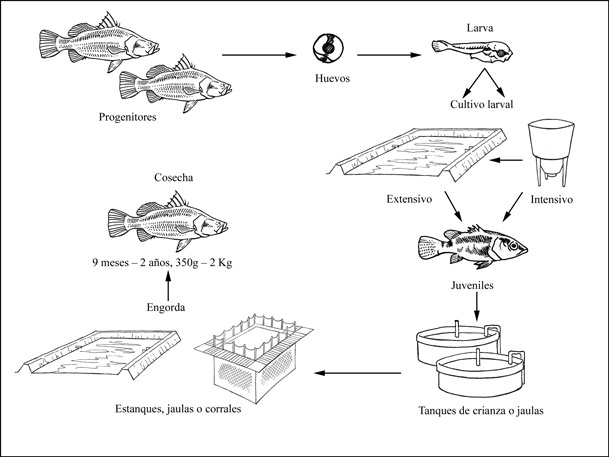
Ciclo de producción de Lates calcarifer
Sistemas de producción
Suministro de semilla
Aunque en algunas partes de Asia, los alevines de perca gigante aún se recolectan en su habitat natural, la mayor parte de la semilla se produce en criaderos. La tecnología de producción en criaderos ha sido debidamente desarrollada dentro del rango de cultivo de esta especie.
Crianza de alevines
Los progenitores de perca gigante se mantienen en jaulas flotantes o en tanques de concreto o fibra de vidrio. Pueden mantenerse en agua dulce o marina, pero deben colocarse en agua de mar (28–35‰) antes de la temporada de reproducción para favorecer la maduración final gonadal. La perca gigante no da muestras externas obvias de desarrollo gonadal y debe ser examinada por canulación para determinar su género y estado reproductivo, aunque es posible extraer semen fácilmente de los machos durante la temporada de reproducción.
Los reproductores de perca gigante se suelen alimentar suministrando pescado de fauna de acompañamiento o con carnada de pescado disponible en el mercado. Para mejorar la composición nutricional en la dieta de los reproductores y prevenir enfermedades asociadas con deficiencias vitamínicas, se puede inyectar o mezclar un complemento de vitaminas a la carnada antes de la alimentación.
La perca gigante asiática es inducida al desove mediante la manipulación de parámetros ambientales (salinidad y temperatura) para simular la migración a la parte baja de los estuarios y el régimen de mareas durante la temporada natural de desove. Las mismas técnicas no han tenido éxito con las poblaciones australianas de perca gigante, las cuales requieren de la inducción hormonal para desovar. La perca gigante ha sido desovada con éxito utilizando una variedad de hormonas en diversas dosis, las cuales han sido administradas con técnicas que incluyen la inyección, granulados de lengta liberación de colesterol y bombas osmóticas. El desove inducido de la perca gigante se lleva a cabo utilizando hormonas análogas que liberan hormona leutenizante (LHRHa) (Des-Gly10)D-Ala6,Pro9-LH-RH etilamida y (Des-Gly10)D-Trp6, Pro9-LH-RH etilamida.
El comportamiento anterior al desove involucra el apareamiento del macho con la hembra, donde el macho frota su superficie dorsal contra la zona de las papilas genitales de la hembra, yergue sus aletas y “trepida”. En ausencia de este comportamiento, puede ocurrir que se liberen los huevos, pero no se fertilizan. El desove ocurre 34–38 horas después de la inyección, al atardecer y puede estar acompañado de aleteo violento en la superficie del agua. La perca gigante desovará durante cinco noches consecutivas.
Durante el desove, los huevos y el esperma son librados en la columna de agua y la fertilización ocurre de manera externa. Los huevos de perca gigante miden 0,74–0,80 mm de diámetro con una gota aceitosa de 0,23–0,26 mm de diámetro. Los huevos se recolectan en los tanques de desove utilizando redes de malla fina (cerca de 300 µm) a través de las cuales se separa el agua. Si la perca gigante desova en jaulas, éstas se recubren con una red hapa o “hamaca” de malla fina que retiene los huevos dentro de la jaula, permitiendo su remoción.
Los huevos fertilizados se desarrollan rápidamente y la incubación ocurre 12–17 horas después en una temperatura de 27–30 °C. Las larvas recién eclosionadas tienen una yema que se absorbe rápidamente durante las siguientes 24 horas, desapareciendo 50 horas después del desove. El glóbulo aceitoso es absorbido más lentamente y persiste hasta 140 horas después de la incubación. La boca e intestinos se desarrollan al día siguiente de la incubación (día dos) y las larvas comienzan a alimentarse 45–50 horas después.
Producción en viveros
La perca gigante se cría utilizando técnicas intensivas de “agua verde”, en tanques de concreto circulares o rectangulares o en tanques de lona circulares de hasta 26 m³. Se adiciona un cultivo de micro alga (generalmente Tetraselmis spp. o Nannochloropsis oculata) a los tanques de cría en densidades de entre 8–10×10³ y 1–3×105 células/ml. La perca gigante criada de manera intensiva se alimenta de rotíferos (Brachionus plicatilis) desde el día dos (día uno es el día del desove) hasta el día 12 (o inclusive día 15), y de artemia (Artemia sp.) a partir del día 8. Tanto los rotíferos como la artemia son cultivados a base de micro algas o productos enriquecedores comerciales para aumentar sus niveles de ácidos grasos insaturados. Se han utilizado cladoceros como la Daphnia y Moina para complementar o remplazar a la artemia como alimento para las larvas de perca gigante cultivadas intensivamente. La supervivencia final de larvas de perca gigante criadas intensivamente a partir de la incubación hasta que alcanzan los 10 mm LT varía entre 15 y 50 por ciento. Recientemente se han utilizado microdietas compuestas para reemplazar parcial o totalmente a la artemia en la cría intensiva de larvas de perca gigante.
También se producen alevines de perca gigante utilizando procedimientos de cría extensiva (en estanques). Las superficies de los estanques utilizados para este tipo de cultivo van de 0,05 a 1 ha y pueden ser excavados en tierra o estar recubiertos de plástico. Son relativamente someros (<2 m) para favorecer la productividad primaria y prevenir la estratificación. Los estanques de cría de larvas son fertilizados a base de fertilizantes inorgánicos y orgánicos para propiciar la abundancia de zooplancton apetecido por las larvas de perca gigante. Las larvas se estabulan en densidades de 400 000–900 000/ha. La gestión continua de los estanques se orienta al mantenimiento de poblaciones apropiadas de zooplancton y a asegurar la adcuada calidad del agua. La perca gigante se cosecha en los estanques cuando alcanza los 25 mm de longitud total o más (tres semanas después de la estabulación), y se transfiere a tanques de cría. La sobrevivencia de la perca gigante cultivada extensivamente es de aproximadamente un 20 por ciento, pero es muy variable, pudiendo oscilar desde cero hasta 90 por ciento. Se han alcanzado tasas de producción de hasta 640 000 peces/ha bajo cultivo extensivo.
Criadero
Los juveniles de perca gigante (1,0–2,5 cm LT) pueden ser estabulados en jaulas de cría flotantes o fijas en ríos, zonas costeras o estanques, o directamente en estanques o tanques de cría de agua dulce o salobre. Los peces se alimentan de peces forrajeros molidos (4–6 mm) o pequeños gránulos. El pescado puede ser enriquecido con vitaminas en una proporción del 2 por ciento. Esta fase de cría dura de 30 a 45 días; una vez que los alevines alcanzan los 5–10 cm de LT, se transfieren a estanques de crecimiento.
El canibalismo puede ser una causa importante de mortandad durante la etapa de crianza y durante el crecimiento temprano debido a que la perca gigante come peces de su propia especie de hasta un 61–67 por ciento de su propia talla. El canibalismo puede comenzar durante las etapas tardías de la cría de larvas y es más pronunciado en peces de menos de 150 mm LT; en peces más grandes, genera menos pérdidas. El canibalismo se reduce seleccionando y separando los peces a intervalos regulares (normalmente cada 7 a 10 días) para garantizar que los peces de cada jaula sean de tamaño similar.
Técnicas de engorda
Generalmente el cultivo de perca gigante se lleva a cabo en jaulas de red. Se utilizan tanto jaulas fijas como flotantes; éstas varían en tamaño de 3×3 m hasta 10×10 m, y 2–3 m de profundidad. En Australia y Estados Unidos, se han establecido varias granjas de perca gigante que utilizan sistemas de recirculación de agua dulce o salobre con una combinación de filtración física y biológica. Estas granjas pueden ubicarse en regiones donde no se podría cultivar perca gigante debido a las bajas temperaturas (el sur de Australia, el noreste de Estados Unidos). La principal ventaja de estos sistemas de cultivo es que pueden situarse cerca de los mercados de la región, reduciendo los costos de transporte del producto final.
Las densidades de estabulación utilizadas para el cultivo en jaulas varían de 15 a 40 kg/m³, aunque pueden llegar hasta los 60 kg/m³. Generalmente, a mayor densidad se obtienen menores tasas de crecimiento pero este efecto es inferior en densidades por debajo de los 25 kg/m³. La perca gigante cultivada en sistemas de recirculación se estabula en densidades de 15 kg/m³.
También se cultiva perca gigante en estanques de tierra o forrados de plástico (sin jaulas), una técnica conocida en Australia como 'pastoreo libre'. Los juveniles de perca gigante (20–100 g) se cultivan en estanques de agua salobre en densidades de 0,25–2,0 peces/m². En Asia, la perca gigante puede cultivarse en policultivo en estanques de agua salobre con tilapia (Oreochromis spp.) como fuente de alimento.
Suministro de alimento
La mayoría de los cultivos de perca gigante emplean alimentos balanceados, aunque en algunas regiones, donde es más barato o hay mayor disponibilidad, aún se utilizan peces forrajeros. La perca gigante alimentada con peces forrajeros reciben el alimento dos veces al día a razón de 8–10 por ciento de su peso corporal para los individuos que pesan hasta 100 g, reduciéndolo a 3–5 por ciento del peso corporal para los individuos con un peso superior a los 600 g. Puede agregarse compuestos vitamínicos a los peces basura en proporción del 2 por ciento, o puede agregarse arroz en germen o roto para aumentar la cantidad de alimento a un costo mínimo. Las tasas de conversión alimenticia (FCRs, por sus siglas en inglés) de la perca gigante alimentada con peces forrajeros, con un rango de 4:1 a 8:1.
La perca gigante alimentada con balanceados se alimenta dos veces al día en los meses cálidos y una vez al día en invierno. Las granjas más grandes utilizan sistemas de automáticos de alimentación, mientras que las granjas más pequeñas alimentan manualmente. La perca gigante ha alcanzado coeficientes de conversión alimenticia de 1,0–1,2:1 bajo condiciones experimentales, pero en condiciones de granjas comerciales son comunes alcanzar tasas de conversión alimenticia de 1,6–1,8:1. Las tasas de conversión alimenticia varían con la temporada, aumentando hasta más de 2,0:1 durante el invierno.
Para la perca gigante cultivada en jaulas, la cosecha es relativamente simple, concentrando los peces en una parte de la jaula (normalmente se levanta parte de la red) y sacándolos mediante una red cuchara. La cosecha de perca gigante en estanques bajo 'pastoreo libre' es más difícil y requiere de una redada en el estanque o drenar por completo el estanque para poder cosecharla.
Tras la cosecha, la perca gigante se coloca sobre una solución de hielo líquido para sacrificarla humanamente y preservar la calidad de la carne. En Australia, la mayoría de las granjas no procesan el pescado sino lo venden con vísceras. Algunas granjas más grandes tienen instalaciones de procesamiento para filetear los peces más grandes (2–3 kg). La perca gigante fresca se transporta en bolsas de plástico en contenedores de poliestireno con hielo. Hay un mercado limitado para la perca gigante viva en Australia y el sudeste asiático. En estos casos, los peces son transportados vivos en tanques sobre camiones.
Los modelos económicos de cultivo de perca gigante en Australia han estimado el costo del punto de equilibrio para una granja pequeña (50 toneladas/año) en 9,25 AUD/kg (6,90 USD/kg), mientras que para una granja de 200 toneladas/año desciende a 6,90 AUD (5,1 USD). Las granjas más grandes (>1 000 toneladas/año) pueden sacar ventaja de las economías de escala y sus costos de producción están alrededor de los 6–7 AUD/kg (4,50–5,25 USD/kg). Por otra parte, las granjas de perca gigante en Tailandia producen peces con un costo de 1,90 USD/kg. El modelo económico de las granjas australianas indican que la utilidad es altamente sensible al precio: una disminución de 1,00 AUD (0,75 USD) genera una reducción del 80 por ciento en las utilidades anuales equivalentes.
El Departamento de Queensland de Industrias Primarias y Pesca (http://www.dpi.qld.gov.au) ha puesto a disposición de los acuicultores modelos económicos para las granjas de cultivo de perca gigante.
La perca gigante alimentada con balanceados se alimenta dos veces al día en los meses cálidos y una vez al día en invierno. Las granjas más grandes utilizan sistemas de automáticos de alimentación, mientras que las granjas más pequeñas alimentan manualmente. La perca gigante ha alcanzado coeficientes de conversión alimenticia de 1,0–1,2:1 bajo condiciones experimentales, pero en condiciones de granjas comerciales son comunes alcanzar tasas de conversión alimenticia de 1,6–1,8:1. Las tasas de conversión alimenticia varían con la temporada, aumentando hasta más de 2,0:1 durante el invierno.
Técnicas de cosecha
Para la perca gigante cultivada en jaulas, la cosecha es relativamente simple, concentrando los peces en una parte de la jaula (normalmente se levanta parte de la red) y sacándolos mediante una red cuchara. La cosecha de perca gigante en estanques bajo 'pastoreo libre' es más difícil y requiere de una redada en el estanque o drenar por completo el estanque para poder cosecharla.
Manipulación y procesamiento
Tras la cosecha, la perca gigante se coloca sobre una solución de hielo líquido para sacrificarla humanamente y preservar la calidad de la carne. En Australia, la mayoría de las granjas no procesan el pescado sino lo venden con vísceras. Algunas granjas más grandes tienen instalaciones de procesamiento para filetear los peces más grandes (2–3 kg). La perca gigante fresca se transporta en bolsas de plástico en contenedores de poliestireno con hielo. Hay un mercado limitado para la perca gigante viva en Australia y el sudeste asiático. En estos casos, los peces son transportados vivos en tanques sobre camiones.
Costos de producción
Los modelos económicos de cultivo de perca gigante en Australia han estimado el costo del punto de equilibrio para una granja pequeña (50 toneladas/año) en 9,25 AUD/kg (6,90 USD/kg), mientras que para una granja de 200 toneladas/año desciende a 6,90 AUD (5,1 USD). Las granjas más grandes (>1 000 toneladas/año) pueden sacar ventaja de las economías de escala y sus costos de producción están alrededor de los 6–7 AUD/kg (4,50–5,25 USD/kg). Por otra parte, las granjas de perca gigante en Tailandia producen peces con un costo de 1,90 USD/kg. El modelo económico de las granjas australianas indican que la utilidad es altamente sensible al precio: una disminución de 1,00 AUD (0,75 USD) genera una reducción del 80 por ciento en las utilidades anuales equivalentes.
El Departamento de Queensland de Industrias Primarias y Pesca (http://www.dpi.qld.gov.au) ha puesto a disposición de los acuicultores modelos económicos para las granjas de cultivo de perca gigante.
Enfermedades y medidas de control
En el siguiente cuadro se presentan las principales enfermedades a las que es susceptible la perca gigante.
En algunos casos se han utilizado antibióticos y otros farmacéuticos para el tratamiento de la perca gigante; sin embargo, su inclusión en esta tabla no significa una recomendación por parte de la FAO.
Expertos en patologías
Las siguientes Fuentes pueden suministrar asistencia:
En algunos casos se han utilizado antibióticos y otros farmacéuticos para el tratamiento de la perca gigante; sin embargo, su inclusión en esta tabla no significa una recomendación por parte de la FAO.
| ENFERMEDAD | AGENTE | TIPO | SÍNDROME | MEDIDAS |
| Necrosis nerviosa viral (VNN, por sus siglas en inglés) | Lates calcarifer vírus encefálico (LcEV) – betanodavirus | Virus | Coloración pálida u oscura; comportamiento errático; nado en espiral; inflamación; “desmayos”; vacuolación extensiva del cerebro y columna vertebral; suele presentarse en la fase de cría | Monitoreo de reproductores; bajas densidades de cría de larvas; nutrición óptima de larvas; mejorar nutrición de reproductores; mejorar higiene en criaderos |
| Lymphocystis | Virus lymphocystis | Virus | Crecimientos verrugosos en piel y aletas; solo es fatal si la infección es severa y está relacionada con malas condiciones ambientales | Remoción de peces infectados; mejora del ambiente |
| Vibriosis | Vibrio harveyi; Vibrio spp. | Bacterias | Oscurecimiento en peces marinos; letargos; anorexia; úlceras; fluido abdominal rojizo; relacionado con sistemas de cría, malas condiciones ambientales y trauma epidérmico | Mejora del ambiente; tratamientos antibióticos |
| Septicemia hemorrágica bacterial | Aeromonas hydrophila; Aeromonas sobria; Aeromonas caviae; Aeromonas spp.; Pseudomonas sp. | Bacterias | Peces de agua dulce con úlceras rojizas en la piel; letargos; anorexia; fluido abdominal rojizo; branquias pálidas, relacionado con malas condiciones ambientales y trauma epidérmico | Mejora del ambiente; tratamientos antibióticos |
| Bacteriosis integumentaria | Aeromonas sobria; Aeromonas hydrophila; Vibrio harveyi; Vibrio alginolyticus | Bacterias | Úlceras irregulares rojizas en la piel; pérdida de escamas; relacionado con malas condiciones ambientales y trauma epidérmico | Mejora del ambiente; aumentar recambio de agua |
| Streptococcosis | Streptococcus iniae | Bacterias | Oscurecimiento; anorexia; branquias pálidas; fluido abdominal rojizo; órganos abdominales y paredes internas rojizas | Tratamientos antibióticos; vacunas |
| Enfermedad de Columnaris | Flavobacterium columnare; Flavobacterium johnsoniae; y Flavobacterium sp. (formas deslizantes) en agua dulce Tenacibaculum marinimum en agua marina | Bacterias | Manchas claras en la superficie dorsal detrás de la aleta dorsal y en el pedúnculo caudal; letargia; ocurre principalmente en la fase de cría; en los juveniles más grandes se forma una erosión en la piel de la boca alrededor de las mandíbulas superior e inferior; relacionado con sobre-estabulación, cría en tanques, poca higiene y trauma epidérmico | Tratamiento en permanganato de potasio o baños de cobre durante las primeras etapas de la enfermedad; tratamientos antibióticos |
| Enfermedad bacterial de branquias | Varias bacterias; Flavobacterium spp.; Cytophaga spp. | Bacterias | Natación en la superficie; tragos de aire; rápidos movimientos operculares; exceso de mucosa en branquias; manchas blancas en branquias; se presenta en la etapa de cría | Mejorar calidad del agua; tratamiento con reversion de salinidad, permanganato de potasio o baños de amonio cuaternario; aumentar recambio de agua; reducir densidad de estabulación |
| Peritonitis bacterial | Varias bacterias gram negativas y positivas incluyendo Vibrio harveyi & Aeromonas hydrophila | Bacterias | Oscurecimiento; letargia; abdomen inflamado; adhesiones y fluidos hediondos en el abdomen; fístulas abdominales; más común en sistemas de recirculación | Eliminar peces enfermos; tratamientos antibióticos |
| Enterites bacteriana | Varias bacterias gram negativaso | Bacterias | Enfermedad aguda en sistemas intensivos de cría de larvas; anorexia; cabezas de alfiler; oscurecimiento y muerte | Eliminar lote completo de larvas infectadas |
| Putrefacción de aletas y cola | Aeromonas spp.; Pseudomonas spp.; Vibrio spp.; Flavobacterium spp.; Cytophaga spp. | Bacterias | Erosión de tejidos blandos en alteas y cola; puede extenderse a toda la cola y el pedúnculo caudal | Mejorar entorno; reducir densidades de estabulación |
| Epiteliocystis | Organismo Epitheliocystis – a Chlamydia | Bacteria | Natación en la superficie; rápidos movimientos operculares; la enfermedad es poco común pero se ha detectado en peces marinos y en sistemas de recirculación | Ninguna conocida |
| Mancha blanca | Ichthyophthirius multifiliis en agua dulce Cryptocaryon irritans en agua de mar | Protozoa | 'Destellos'; frotación de piel sobre superficies; anorexia; natación en superficie; manchas blancas en piel y aletas | Tratamiento con reversión de salinidad, baños de formalina o combinaciones; tratamiento en baños de cobre para peces marinos |
| Chilodonelliasis | Chilodonella spp.; Chilodonella hexasticha | Protozoa | Natación en superficie; rápidos movimientos operculares; se presenta en malas condiciones ambientales y peces débiles | Tratamiento con baños de sal, formalina o permanganato de potasio, o combinaciones |
| Trichodiniasis | Complejo Trichodina spp. | Protozoa | Natación en superficie; rápidos movimientos operculares; exceso de mucosidad en branquias; se presenta tras bajas temperaturas del agua, altas cargas orgánicas y altas densidades de estabulación | Aumentar recambio de agua; tratamiento con baños de sal o formalina |
| Ichthyobodosis (costiasis) | Ichthyobodo necator | Protozoa | 'Destellos'; frotación de piel sobre superficies; manchas opacas en la piel; escamas levantadas; natación en la superficie; rápidos movimientos operculares; opérculo levantado | Tratamiento con reversión de salinidad; baños de formalina o permanganato de potasio |
| Piscinoodiniasis | Piscinoodinium sp. | Protozoa | Se presenta en agua dulce. En los peces más jóvenes, manchas opacas o verdiosas en la piel; levantamientos de la piel o úlceras. En peces más viejos, rápidos movimientos operculares; exceso de mucosa en branquias; coloración verde oscuro en branquias | Tratamiento con baños de sal |
| Amyloodiniasis | Amyloodinium ocellatum | Protozoa | Se presenta en condiciones marinas. En peces jóvenes, manchas opacas o verdiosas en la piel; levantamientos de la piel y úlceras. En peces viejos, rápidos movimientos operculares; exceso de mucosa en branquias; color verde oscuro en branquias; común en reproductores y en canales de flujo rápido, relacionado con bajas temperaturas del agua o rápidos descensos de temperatura | Tratamiento con agua dulce, baños de cobre, formalina o peróxido de hidrógeno |
| Enfermedad de llagas rojas | Epistylis sp. | Protozoa | Úlceras en la piel de peces en estanques de agua dulce; superficie hinchada e infecciones bacteriales secundarias | Reducir niveles orgánicos del agua; tratamiento con baños de formalina |
| Gusano de las branquias | Diplectanum sp.; Dactylogyrus sp. | Tremátodos Monogenésicos | Rápidos movimientos oeprculares; anorexia; manchas blancas en branquias | Tratamiento con reversión de salinidad; baños de formalina, órgano-fosfato o praziquantel |
| Gusano de la piel | Neobenedinia melleni; Gyrodactylus spp. | Tremátodos Monogenésicos | Peces marinos con corneas opacas; manchas blancas en la piel; úlceras; asociado a altas salinidades y bajas temperaturas acuáticas | Tratamiento en agua dulce o baños de peróxido de hidrógeno |
| Myxosporidiosis | Henneguya sp.; Kudoa sp. | Protozoo que forma esporas | La enfermedad es poco común pero se notan quistes de esporas histológicas en los filamentos branquiales (Henneguya sp.) y cerebro (Kudoa sp.) | Ninguna conocida |
| Microsporidiosis | Pleistophora sp. | Protozoo que forma esporas | Grumos inflamados en la piel; nódulos blancos suaves en músculos | Ninguna conocida |
| Micosis integumentaria | Saprolegnia spp.; Achlya spp. | Hongos | Crecimientos alzados algodonosos en la piel y aletas; asociado a bajas temperaturas del agua y trauma epidérmico | Reversión de salinidad y baños de formalina; no manejar peces cuando se presenten bajas temperaturas del agua. |
| Branchiomycosis | Brachiomyces sp.; Achlya spp. | Hongos | Natación en la superficie; rápidos movimientos operculares; manchas blancas y rojas (moteadas) en branquias; asociado a bajas temperaturas del agua y altas cargas orgánicas | No se conoce tratamiento; reducir carga orgánica y aumentar recambio de agua |
| Piojo del pescado | Argulus sp. | Copépodo | Parásito con forma de disco visible en la piel; focos rojos; oscurecimiento | Tratamiento en baños de organofosfato |
| Gusano ancla | Lernaea sp. | Copépodo | Cuerpo delgado de parásito hembra visible en la piel con pequeñas úlceras rojas donde penetra | Tratamiento en baños de organofosfato |
Expertos en patologías
Las siguientes Fuentes pueden suministrar asistencia:
- Fisheries College - Ocean University of China
Yushan Road No. 5- Qingdao Shandong Province - 26003 China
Telephone: +86-532-2032284 Fax: +86-532-2894024
Contact: Dr. Wen-Bin Zhan, Dean. - Fish Health Unit - Animal Health Laboratory - Department of Fisheries - Government of Western Australia
3 Baron-Hay Court - South Perth - WA 6151 - Australia
Telex: +61 (08) 9368 3649 - Fax: +61 (08) 9474 1881
Contact: Dr. Brian Jones, Principal Fish Pathologist. - Inland Aquatic Animal Health Research Institute - Department of Fisheries - Kasetsart University Campus
Jatujak - Lardyao - Bangkok - 10900 - Thailand
Telephone: +66 (02) 579 4122 - Fax: +66 (02) 516 3993
Contact: Dr. Suda Tandavanitj, Director. - Intervet Norbio - Singapore Pte. Ltd
1 Perahu Road - Singapore - 718847 - Singapore
Telephone: +65 6397 1121 - Fax: +65 6397 1131
Contact: Dr. Luc Grisez, Research Manager. - Maricultural Organism Disease Control and - Molecular Pathology Laboratory - Yellow Sea Fisheries Research Institute - Chinese Academy of Fishery Sciences
106 Nanjing Road - Qingdao - Shandong Province - 266071 - China
Telephone: +86-532-5823062 - Fax: +86-532-5811514
Contact: Dr. Huang Jie. - Shenzhen Exit-Entry Inspection and Quarantine Bureau
Shenshen - 518001 - China
Telephone: +86-755-25592980
Contact: Professor Jiang Yulin, Director.
ESTADÍSTICAS
Estadísticas de producción
|
Producción de acuicultura global de Lates calcarifer
(FAO Estadísticas pesqueras) 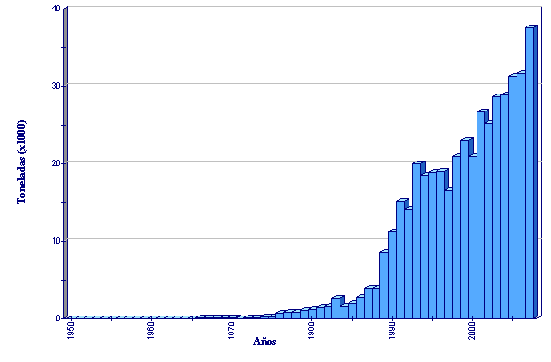
|
|
Market and trade
En Asia, la mayor parte de la perca gigante se vende cuando pesa 500–900 g, aunque también se venden cantidades menores de peces más grandes (1–3 kg).
En Australia, existen dos productos de perca gigante cultivada: 'tamaño plato' y filete. Los peces 'tamaño plato' varían de 350 a 500 g, aunque se encuentran peces más grandes (banquete), de hasta 800 g. Los peces aptos para filetes pesan entre 2 y 3 kg.
Se han hecho pocos esfuerzos en desarrollar productos con valor agregado a partir de perca gigante. En Australia existen algunos proveedores de perca gigante ahumada. A lo largo de su rango de cultivo, la perca gigante viva se vende a restaurantes especializados en productos marinos vivos, pero es una proporción muy pequeña del mercado total.
Existe relativamente poco comercio internacional de perca gigante, ya que la mayoría se consume localmente. Una excepción es el cultivo de perca gigante en sistemas de recirculación en Estados Unidos que importan alevines desde Australia por la vía aérea.
La Asociación Australiana de Productores de Perca Gigante ha adoptado estándares de calidad del producto para resolver la cuestión de la variabilidad en la calidad en el mercado australiano. Los detalles se pueden encontrar en su sitio web (ver Vínculos relacionados).
En Australia, existen dos productos de perca gigante cultivada: 'tamaño plato' y filete. Los peces 'tamaño plato' varían de 350 a 500 g, aunque se encuentran peces más grandes (banquete), de hasta 800 g. Los peces aptos para filetes pesan entre 2 y 3 kg.
Se han hecho pocos esfuerzos en desarrollar productos con valor agregado a partir de perca gigante. En Australia existen algunos proveedores de perca gigante ahumada. A lo largo de su rango de cultivo, la perca gigante viva se vende a restaurantes especializados en productos marinos vivos, pero es una proporción muy pequeña del mercado total.
Existe relativamente poco comercio internacional de perca gigante, ya que la mayoría se consume localmente. Una excepción es el cultivo de perca gigante en sistemas de recirculación en Estados Unidos que importan alevines desde Australia por la vía aérea.
La Asociación Australiana de Productores de Perca Gigante ha adoptado estándares de calidad del producto para resolver la cuestión de la variabilidad en la calidad en el mercado australiano. Los detalles se pueden encontrar en su sitio web (ver Vínculos relacionados).
ESTATUS Y TENDENCIAS
Se han realizado esfuerzos considerables de investigación sobre la acuicultura de la perca gigante desde 1970, lo que ha contribuido a la estabilidad y eficiencia de la producción de esta especie. Debido a la madurez de la industria, se efectúa relativamente poca investigación en curso. La mayoría de los institutos de investigación involucrados en el desarrollo de tecnologías de cultivo para la perca gigante estudian ahora otras especies, tales como los meros, chernas, etc. Una área de reconocida necesidad de investigación es la que se refiere a programas de selección genética para lograr un crecimiento más rápido y obtener una mayor resistencia a las enfermedades.
Otra área de investigación, que concierne a toda la industria del cultivo de peces marinos en Asia se refiere a la evaluación del impacto ambiental de la acuicultura en jaulas. La rápida expansión de la acuicultura de peces marinos en Asia está provocando diversos impactos (ver Temas de Importancia). Aunque se realiza investigación respecto a la disminución de estos impactos y sobre la planeación del desarrollo de la acuicultura costera, el desarrollo de la planeación e implementación de marcos de trabajo para asegurar la sustentabilidad de la acuicultura costera en jaulas sigue siendo un reto para muchos países.
En la mayoría de los países asiáticos donde se cultiva esta especie, el mercado de la perca gigante no se ha desarrollado en general, ya es un producto relativamente barato y el interés de los piscicultores está en el cultivo de especies de alto valor, tales como meros, chernas, etc.
Los principales temas a tratar son:
Otra área de investigación, que concierne a toda la industria del cultivo de peces marinos en Asia se refiere a la evaluación del impacto ambiental de la acuicultura en jaulas. La rápida expansión de la acuicultura de peces marinos en Asia está provocando diversos impactos (ver Temas de Importancia). Aunque se realiza investigación respecto a la disminución de estos impactos y sobre la planeación del desarrollo de la acuicultura costera, el desarrollo de la planeación e implementación de marcos de trabajo para asegurar la sustentabilidad de la acuicultura costera en jaulas sigue siendo un reto para muchos países.
En la mayoría de los países asiáticos donde se cultiva esta especie, el mercado de la perca gigante no se ha desarrollado en general, ya es un producto relativamente barato y el interés de los piscicultores está en el cultivo de especies de alto valor, tales como meros, chernas, etc.
Los principales temas a tratar son:
- Establecimiento de programas de selección genética para lograr un crecimiento más rápido y una mayor resistencia a las enfermedades.
- Mejoría de la comercialización de perca gigante, tanto en países productores como internacionalmente, para expandir la demanda del mercado.
- Desarrollo de productos con valor agregado para expandir la demanda del mercado en los países industrializados.
PRINCIPALES ASUNTOS
Los impactos ambientales asociados al cultivo de peces marinos en jaulas se derivan de los aportes de nutrientes de los alimentos no ingeridos y los desechos de los peces. Por ejemplo, estudios realizados en Hong Kong indican que 85 por ciento de fósforo, 80–88 por ciento de carbono y 52–95 por ciento de nitrógeno (del aporte de peces forrajeros) en las jaulas de peces de aletas puede perderse a través de alimentos no ingeridos, así como de desechos fecales y urinarios. Estos aportes de nutrientes, aunque pequeños en comparación con otras descargas costeras, pueden llevar a la degradación local del agua y a la acumulación de sedimentos. En casos severos, esta “auto-contaminación” puede llevar a que las granjas de jaulas excedan la capacidad del medio ambiente local de proveer aportes (tales como oxígeno disuelto) y asimilar desechos, contribuyendo a brotes de enfermedades y a la degradación de la sustentabilidad.
Prácticas de acuicultura responsable
En Australia, la Asociación Acuícola de Queensland elaboró y adoptó un código ambiental de practicas para la acuicultura de peces de agua dulce. Este código aún no ha sido adoptado por la Asociación Australiana de Acuicultores de Perca Gigante, pero dicho código puede sentar un precedente para el establecimiento de códigos similares para el cultivo de perca gigante en estanques de agua dulce.
La Asociación Australiana de Acuicultores de Perca Gigante desarrolló y adoptó un Código de Prácticas para el manejo tras la Cosecha de Perca Gigante cultivada; su objetivo es mejorar la calidad del producto por medio de mejores prácticas de manejo.
Un código genérico para el manejo de productos acuáticos vivos son los “Lineamientos sobre el bienestar de peces y crustáceos vivos para consume humano” (ver Vínculos Relacionados).
El cultivo de perca gigante también debe adherirse a los principios generales establecidos por el Código de Conducta para la Pesca Responsable de la FAO y los Lineamientos Técnicos
La Asociación Australiana de Acuicultores de Perca Gigante desarrolló y adoptó un Código de Prácticas para el manejo tras la Cosecha de Perca Gigante cultivada; su objetivo es mejorar la calidad del producto por medio de mejores prácticas de manejo.
Un código genérico para el manejo de productos acuáticos vivos son los “Lineamientos sobre el bienestar de peces y crustáceos vivos para consume humano” (ver Vínculos Relacionados).
El cultivo de perca gigante también debe adherirse a los principios generales establecidos por el Código de Conducta para la Pesca Responsable de la FAO y los Lineamientos Técnicos
REFERENCIAS
Bibliografía
| Barlow, C.G. 1981. Breeding and larval rearing of Lates calcarifer (Bloch) (Pisces: Centropomidae) in Thailand. New South Wales State Fisheries Report. 8 pp. New South Wales Department of Fisheries, Sydney, Australia. |
| Buendia, R. 1997. Seabass grow-out and marketing: lessons from Australia, Malaysia and Thailand. SEAFDEC Asian Aquaculture 19: 27-28. |
| Copland, J.W. & Grey, D.L. 1987. Management of wild and culture sea bass / barramundi (Lates calcarifer): proceedings of an international workshop held at Darwin, N.T., Australia, 24-30 September 1986. ACIAR Proceedings No. 20, Australian Centre for International Agricultural Research, Canberra, Australia. 210 pp. |
| Johnston, W.L. 1998. Commercial barramundi farming – estimating profitability. Queensland Department of Primary Industries, Brisbane, Australia. 16 pp. |
| Phillips, M.J. 1998. Tropical Mariculture and Coastal Environmental Integrity. In: S.S. De Silva (ed), Tropical Mariculture, pp. 17-69. Academic Press, London, England. |
| Rimmer, M.A. 1995. Barramundi Farming – An Introduction. Queensland Department of Primary Industries Information Series, QI95020. 26 pp. Queensland Department of Primary Industries, Brisbane, Australia. |
| Rimmer, M.A. 2003. Barramundi. In: J.S. Lucas & P.C. Southgate (eds), Aquaculture: Farming Aquatic Animals and Plants, pp. 364-381. Blackwell Publishing, Oxford, England. pp. 364–381. |
| Rimmer, M.A. & Russell, D.J. 1998. Aspects of the Biology and Culture of Lates calcarifer. In: S.S. De Silva (ed.). Tropical Mariculture, pp. 449–476. Academic Press, London England. |
| Wu, R. 1995. The environmental impact of marine fish culture: towards a sustainable future. Marine Pollution Bulletin, 31:159–166. |