
|
|||||||||
|
|
||||||||
FAO. 2009.
Penaeus indicus. In Cultured aquatic species fact sheets. Text by
Radhakrishnan, E.V.
Edited and compiled by Valerio Crespi and Michael New. CD-ROM (multilingual). |
|||||||||
IDENTIDAD
Rasgos biológicos
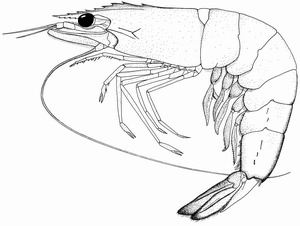
Caparazón más bien liso, sin crestas gastrofrontales y hepáticas; la cresta adrostral se extiende hasta o justo antes del diente epigástrico; el rostro ligeramente curvo hacia la punta y tiene forma sigmoidal, con 7 a 9 dientes superiores (incluyendo los del caparazón) y de 3 a 6 dientes inferiores; la cresta del rostro es ligeramente elevada en los especímenes más grandes incluyendo las hembras adultas (aunque aún con crestas ligeramente más altas en hembras que en machos); la cresta post-rostral se extiende hasta cerca del margen posterior del caparazón, extendiéndose hasta 3/5 de la parte distal y 2 a 2/3 de la distancia entre la espina hepática y el margen orbital. En los machos adultos con petasma, el tercer maxilípedo con segmento distal es casi tan largo como el segundo segmento (vista ventral) el cual tiene un mechón de cabellos largos y densos (del mismo largo que el segmento distal) en la punta. La petasma de los machos tiene proyecciones distomedianas curveadas y que sobresalen del margen distal del costado. El télico de las hembras está formado por dos placas laterales semi-circulares, con sus márgenes medios formando labios túmidos; el proceso anterior está ligeramente redondeado y ligeramente convexo; el proceso posterior está alargado e insertado entre la parte anterior de las placas laterales; tanto el proceso anterior como el posterior son diferenciados. Al telson le faltan espinas laterales. Color: el cuerpo es semi-traslúcido, apenas de un blanco amarillento (en especímenes pequeños) o verde grisáceo y cubierto con muchas manchitas cafés, los ojos son café claro y están cubiertos con rayas café oscuro; las crestas dorsal abdominal y rostral son de un café rojizo o café oscuro; las antenas son amarillentas; los flagelos de las antenas son del mismo color que el cuerpo y están cubiertas con manchas oscuras; las patas son traslúcidas y blancuzcas, los pleópodos son amarillentos a rosados; la parte distal de los urópodos son amarillentos con márgenes rojos. Tamaño: largo máximo del cuerpo es de 23 cm (hembras) y 18,4 cm (machos), normalmente menos de 17 cm.
PERFIL

Antecedentes históricos
Existen métodos tradicionales del cultivo en agua salobre en cuatro estados marítimos de la India, es decir, Bengal Occidental, Kerala, Karnataka y Goa. En Kerala, en la costa suroccidental del país, se lleva a cabo el cultivo tradicional de camarón con una cosecha de arrozales tolerantes a la sal durante la estación de lluvias (junio a septiembre) y una cosecha de camarón durante el verano (noviembre a abril). Estos estanques dependen de la marea: la entrada de diversas variedades de camarón y peces se lleva a cabo durante la marea alta. La producción total promedio es de 650 kg/ha/año, con una proporción de camarón del 71 por ciento, del cual un 36 a 43 por ciento corresponde a langostino blanco de la India. Los juveniles dependen completamente de alimentos naturales y su cosecha es periódica, durante los periodos de luna nueva y luna llena. El cultivo comercial de camarón, con siembra selectiva de semilla, comenzó con el establecimiento de incubadoras de camarón por parte de los sectores privado y gubernamental a fines de los 80; estos criaderos produjeron semilla de Penaeus indicus y Penaeus monodon. En India, el cultivo de P. indicus ha quedado rezagado debido a la preferencia de los camaronicultores por producir P. monodon. La contribución de P. indicus a la producción mundial de langostinos cultivados es pequeña – cerca del 1,2 por ciento en 2005. Actualmente se cultiva P. indicus principalmente en Arabia Saudita, Viet Nam, República Islámica del Irán e India.
Principales países productores

Principales países productores de Penaeus indicus (FAO Estadísticas pesqueras, 2006)
Hábitat y biología
El langostino blanco de la India habita las costas de África Oriental, Sudáfrica, Madagascar, el Golfo Pérsico, Pakistán, las costas suroccidental y oriental de la India, Bangladesh, Tailandia, Malasia, Filipinas, Indonesia, el sur de China y la costa norte de Australia. El P. indicus no se entierra, es activo noche y día y prefiere los fondos arenosos y lodosos. Los adultos se encuentran a profundidades menores a los 30 m, aunque también se han pescado a 90 m. El camarón madura y se reproduce en hábitats marinos y pasan sus etapas juvenil y pre-adulta de 30 a 120 mm de longitud total (LT) en estuarios costeros, aguas tranquilas y lagunas. Los juveniles toleran un rango más amplio de salinidad (5-40‰) que los adultos. En la costa suroccidental de la India, los juveniles sostienen una abundante pesquería comercial en las aguas tranquilas y en los arrozales. Las variaciones geográficas en talla durante la primera madurez son evidentes y varían de 130 a 149 mm LT. Las hembras de P. indicus son muy fecundas, cuyo rango de huevos por hembra oscila entre 68 000 y 1 254 200 para organismos de 140 a 200 mm LT. Hay cinco etapas en la maduración del ovario: inmadurez, primera madurez, segunda madurez, madurez y desove. El P. indicus pertenece al grupo de camarones de télico cerrado de thelycum y su reproducción se lleva a cabo inmediatamente después de que las hembras mudan de caparazón. Durante la reproducción, que generalmente ocurre durante la noche, los paquetes de esperma (espermateca) son depositados por el macho de caparazón duro en bélico de la hembra recién ocurrida la muda cuando el caparazón es aún blando. Las hembras llevan la espermateca durante la maduración del ovario y los espermas se dispersan durante el desove. La fertilización es externa, con los huevos fértiles liberados por las hembras fertilizados por el esperma liberado simultáneamente de la espermateca en el télico. Dependiendo de la temperatura, la eclosión se lleva a cabo de 8 a 12 horas después del desove. Los nauplios nadan libremente y no se alimentan, y pasan por seis mudas. Las larvas pasan por protozoea (3 etapas), mysis (3 etapas), y luego a postlarva, que se parece al langostino adulto. Las postlarvas migran a los estuarios, se establecen en el fondo y se alimentan de detritos bentónicos, gusanos poliquetos y pequeños crustáceos, permaneciendo ahí hasta que alcanzan los 110-120 mm LT. Estos sub-adultos regresan al mar y pasan al reclutamiento de la pesquería.
PRODUCCIÓN

En los sistemas tradicionales de filtración a través de arrozales, los juveniles congregados cerca de la compuerta de entrada se les permite la entrada a los campos extensivos durante la marea alta. Anteriormente, se capturaba semilla silvestre y se vendía a los camaronicultores. Sin embargo, con el establecimiento de incubadoras, y también debido a la sobrepesca, se ha reducido la dependencia de semilla silvestre.
Los reproductores de camarón con propósitos de reproducción pueden obtenerse de las áreas de pesca o ser desarrollados en cautiverio mediante maduración inducida de especímenes adultos silvestres (>145 mm TL) y mantenidos en tanques de almacenamiento de reproductores. Cuando se utilizan reproductores silvestres, se transportan cuidadosamente a la incubadora y se mantienen en sistemas de recambio de agua para recuperarlos del estrés. Las hembras grávidas se trasladan individualmente en tanques cilindrocónicos reforzados con fibra de vidrio de 500-1 000 litros, con agua de mar esterilizada y microfiltrada con una salinidad de 30-35‰ y un pH de 8,0-8,2. La temperatura ideal es de 27-31 ºC; el desove ocurre durante la noche, después de lo cual los reproductores son retirados y transferidos a tanques de re-maduración.
La talla de P. indicus utilizada para el desarrollo de reproductores deberá ser superior a los 145 mm LT (20 g) en hembras y de 140 mm (17 g) en machos. Tras un tratamiento profiláctico con 100 ppm de formalina durante 30 minutos, los especímenes se estabulan a razón de 4/m³ y en una proporción de sexo de 1:1 en tanques circulares de 100 toneladas con un filtro biológico in situ. Los tanques se cubren y mantienen en un cuarto oscuro. Tres tanques del tamaño mencionado pueden cubrir los requisitos de una incubadora o laboratorio con capacidad de 18 millones de postlarvas. Los camarones son alimentados diariamente con oligoquetos de la zona intermareal y carne de almeja y calamar. Uno de ambos pedúnculos oculares de las hembras es sujeto a ablación por medio de un aparato de cauterización eléctrica con el objeto de estimular el sistema endócrino.
Los camarones maduran entre 9 y 27 días después de la ablación y el intervalo entre dos desoves consecutivos puede ser de 3 a 15 días. El P. indicus también madura y desova en cautiverio sin ablación, manteniendo el pH entre 8,0 y 8,2, baja intensidad de luz inferior a los 500 lux, y alimentación con oligoquetos y carne fresca de almeja. Sin embargo, las hembras ablacionadas producen diez, ocho y seis veces el número de desoves, huevos y nauplios, respectivamente, comparadas con las hembras no ablacionadas.
Las estimaciones del número total de huevos desovados se obtienen mediante muestreos. La incubación de los huevos se realiza en el mismo tanque. Tras estimar el número total de nauplios incubados, se recolectan, lavan y estabulan en tanques de crecimiento larval. Los criaderos pequeños compran nauplios en centros productores para criarlos hasta la etapa de postlarva debido a que las instalaciones de maduración de reproductores requieren una mayor inversión e infraestructura. Los comercializadores empacan los nauplios a una densidad de 20 000/litro; también se ha desarrollado tecnología para empacar a mayor densidad, hasta 100 000/litro.
Se utilizan tanques interiores más pequeños con capacidad de 2 a 5 toneladas, para criar larvas hasta PL3-5. Los nauplios se estabulan a razón de 75 a 100/litro y se alimentan con una mezcla de cultivos de diatomeas dominada por Chaetoceros spp. o Skeletonema spp. La concentración de diatomeas en los tanques de cultivo de larvas siempre se mantiene sobre las 20 000 células/ml. Desde la segunda o tercera etapa de mysis, las larvas también se alimentan con una mezcla de huevo y camarón en partículas de 100-150 µ, nauplios de Artemia o alimentos microparticulados. Se han logrado resultados exitosos de cría larval sin la inclusión de nauplios de Artemia, que son caros, pero se obtiene una mejor tasa de supervivencia cuando se emplea la Artemia en la alimentación.
Las postlarvas (PL5) procedentes de los tanques de cría larva se transfieren a tanques de cría con capacidad de 10 toneladas donde alcanzan el estadío PL20. A partir de PL5 se utilizan dietas artificiales con el objeto de reducir el deterioro de la calidad del agua. A una densidad de estabulación de 75 nauplii/litro, la supervivencia se estima en 75 por ciento de nauplio a PL5 y de 80 por ciento de PL5 a PL20. Se pueden obtener doce ciclos larvales en 8 meses. Las postlarvas PL20 pueden estabularse directamente en estanques de engorda para su cultivo.
Las prácticas de cultivo del camarón incluyen la tradicional, la extensiva, extensiva modificada, semi-intensiva o intensiva. Las prácticas tradicionales de cultivo se siguen realizando en estanques de marea sobre la costa suroccidental de la India. El cultivo semi-intensivo comercial fue adoptado en países del Medio Oriente y del Golfo Pérsico. El cultivo semi-intensivo de P. indicus en algunas partes de la Inda ha sido reemplazado por P. monodon debido a su mayor rentabilidad económica.
Tradicional
Este sistema de cultivo de camarón, el cual involucra la captura y mantenimiento de juveniles que ingresan al estanque por efectos de la marea, se practica en Bangladesh, India, Indonesia, Myanmar, Filipinas y Viet Nam. En la costa suroccidental de la India, los arrozales de 0,5 a 10 ha sujetos a la influencia de las mareas, se estabulan automáticamente con semillas silvestres de distintas variedades de camarón y peces de noviembre a abril. Estos campos se utilizan por temporadas para monocultivo durante el monzón (junio a septiembre). Los campos mucho más grandes con superficies de 2 a 75 ha y que poseen áreas más profundas, donde el cultivo de arroz es imposible, también se usan para la engorda de camarón a lo largo del año. Los camarones se alimentan naturalmente en los estanques y la producción varía de 400 a 900 kg/ha/año. El P. Indicus conforma 36-43 por ciento del total de la producción de camarón.
Extensivo modificado
Se construyen estanques de 1 a 2 ha con instalaciones independientes de entrada y salida de agua en sitios elevados, lo que permite el drenado total del estanque. Los estanques se fertilizan con fertilizantes orgánicos e inorgánicos, y se estabulan con semilla a razón de 60 000-100 000 organismos/ha. Los camarones se alimentan a partir de alimentos naturales favorecidos por la fertilización del estanque, y complementados con dietas artificiales. El recambio de agua de 10-15 por ciento se realiza diariamente. Se obtiene una producción de 1 000 a 2 500 kg/ha/cosecha en 3 ó 4 meses de cultivo.
Semi-intensivo
Los estanques semi-intensivos se estabulan con semillas producidas en incubadoras a razón de 20 a 25 PL/m². El recambio de agua se realiza con regularidad por medio de bombas. Se utilizan 4-6 aireadores/ha para mantener los niveles deseados de oxígeno disuelto. Se obtienen niveles de producción de 2 500 a 5 000 kg/ha/cosecha.
Intensivo
El cultivo intensivo de P. indicus se introdujo por primera vez cuando se inició el cultivo comercial de camarón a finales de los 80. La densidad de estabulación adoptada fue de 50-100 PL/m². La alimentación con dietas artificiales se realiza 4-5 veces al día. Se practica una intensa aireación y recambio de agua para minimizar el deterioro ambiental. El nivel de producción obtenido varía ebtre 10 000 a 20 000 kg/ha/año, mientras que un empresario declaró una producción de 12 000 kg/ha/cosecha en el sureste indio. Este sistema ya no se practica en la India. Sin embargo, los sistemas intensivos se emplean en Arabia Saudita; una compañía privada ha reportado una producción de 13 500 toneladas de P. indicus de un área total de estanques de 2 800 ha.
En India los camaronicultores usan alimentos comerciales manufacturados localmente (no formulados específicamente para esta especie), así como alimentos importados formulados para Penaeus monodon. Algunos camaronicultores preparan sus propios alimentos, pero son menos nutritivos. El costo de los alimentos importados es más alto. En Arabia Saudita, la Compañía Camaronera Nacional prepara alimentos específicamente formulados para Penaeus indicus ya que cultiva exclusivamente esta especie.
En el cultivo tradicional, la cosecha comienza dos meses después de la estabulación y se lleva a cabo del atardecer al amanecer de 7 a 8 días, alrededor de los periodos de luna llena y luna nueva. Se utilizan redes cónicas cerradas, colocadas en las compuertas durante la marea baja. La cosecha final del cultivo extensivo de realiza a los 3 a 4 meses de engorda. Se drena el agua durante la marea baja y el nivel se reduce aún más por bombeo, utilizando equipos móviles con motor de diesel. Los camarones restantes se cosechan con atarrayas. En los sistemas extensivos modificados, así como en los semi-intensivos, la cosecha se lleva a cabo drenando completamente los estanques, los camarones escapan por la de salidacompuerta y ahí se recolectan en bolsas de red. El resto de la producción se cosecha a mano. En Arabia Saudita, se utilizan técnicas mecanizadas de cosecha.
Se lavan los camarones, se limpian y pesan inmediatamente después de la cosecha, antes de transferirlos a agua fría a 0 ºC. Las cajas rectangulares en donde se colocan son transportadas a las plantas procesadoras en camiones insulados. En las plantas procesadoras, los camarones se limpian y separan y clasifican en varias tallas y categorías para cumplir con los requisitos de exportación. Dependiendo de los requisitos del mercado, los camarones se pueden procesar en varias maneras, tales como marquetas congeladas, listos para comer, fríos enteros, IQF (congelación criogénica individual), y productos preparados, los cuales son exportados en buques contenedores o por aire. Como parte de una estrategia de mercadeo mundial, los principales procesadores y exportadores han adoptado sistemas de control de calidad como HACCP e ISO.
Los costos de producción dependen del sitio, el tipo de sistema de cultivo, la escala de la producción, el número de ciclos productivos anuales, la incidencia de enfermedades, etc. El costo de la producción promedio de semilla en India en 2000 se estimó en 1,6 USD/1 000. El costo del camarón adulto producido en un sistema extensivo modificado fue estimado en 1996 en 4,20 USD/kg pero puesto que esta especie no se cultiva comercialmente en la India (únicamente extensivamente), no se dispone de estimaciones actualizadas. Los costos de producción para esta especie cultivada en Arabia Saudita, no se encuentran disponibles.
Ciclo de producción

Ciclo de producción de Penaeus indicus
Sistemas de producción
Suministro de semilla
En los sistemas tradicionales de filtración a través de arrozales, los juveniles congregados cerca de la compuerta de entrada se les permite la entrada a los campos extensivos durante la marea alta. Anteriormente, se capturaba semilla silvestre y se vendía a los camaronicultores. Sin embargo, con el establecimiento de incubadoras, y también debido a la sobrepesca, se ha reducido la dependencia de semilla silvestre.
Stock de reproductores
Los reproductores de camarón con propósitos de reproducción pueden obtenerse de las áreas de pesca o ser desarrollados en cautiverio mediante maduración inducida de especímenes adultos silvestres (>145 mm TL) y mantenidos en tanques de almacenamiento de reproductores. Cuando se utilizan reproductores silvestres, se transportan cuidadosamente a la incubadora y se mantienen en sistemas de recambio de agua para recuperarlos del estrés. Las hembras grávidas se trasladan individualmente en tanques cilindrocónicos reforzados con fibra de vidrio de 500-1 000 litros, con agua de mar esterilizada y microfiltrada con una salinidad de 30-35‰ y un pH de 8,0-8,2. La temperatura ideal es de 27-31 ºC; el desove ocurre durante la noche, después de lo cual los reproductores son retirados y transferidos a tanques de re-maduración.
La talla de P. indicus utilizada para el desarrollo de reproductores deberá ser superior a los 145 mm LT (20 g) en hembras y de 140 mm (17 g) en machos. Tras un tratamiento profiláctico con 100 ppm de formalina durante 30 minutos, los especímenes se estabulan a razón de 4/m³ y en una proporción de sexo de 1:1 en tanques circulares de 100 toneladas con un filtro biológico in situ. Los tanques se cubren y mantienen en un cuarto oscuro. Tres tanques del tamaño mencionado pueden cubrir los requisitos de una incubadora o laboratorio con capacidad de 18 millones de postlarvas. Los camarones son alimentados diariamente con oligoquetos de la zona intermareal y carne de almeja y calamar. Uno de ambos pedúnculos oculares de las hembras es sujeto a ablación por medio de un aparato de cauterización eléctrica con el objeto de estimular el sistema endócrino.
Los camarones maduran entre 9 y 27 días después de la ablación y el intervalo entre dos desoves consecutivos puede ser de 3 a 15 días. El P. indicus también madura y desova en cautiverio sin ablación, manteniendo el pH entre 8,0 y 8,2, baja intensidad de luz inferior a los 500 lux, y alimentación con oligoquetos y carne fresca de almeja. Sin embargo, las hembras ablacionadas producen diez, ocho y seis veces el número de desoves, huevos y nauplios, respectivamente, comparadas con las hembras no ablacionadas.
Las estimaciones del número total de huevos desovados se obtienen mediante muestreos. La incubación de los huevos se realiza en el mismo tanque. Tras estimar el número total de nauplios incubados, se recolectan, lavan y estabulan en tanques de crecimiento larval. Los criaderos pequeños compran nauplios en centros productores para criarlos hasta la etapa de postlarva debido a que las instalaciones de maduración de reproductores requieren una mayor inversión e infraestructura. Los comercializadores empacan los nauplios a una densidad de 20 000/litro; también se ha desarrollado tecnología para empacar a mayor densidad, hasta 100 000/litro.
Producción en viveros
Se utilizan tanques interiores más pequeños con capacidad de 2 a 5 toneladas, para criar larvas hasta PL3-5. Los nauplios se estabulan a razón de 75 a 100/litro y se alimentan con una mezcla de cultivos de diatomeas dominada por Chaetoceros spp. o Skeletonema spp. La concentración de diatomeas en los tanques de cultivo de larvas siempre se mantiene sobre las 20 000 células/ml. Desde la segunda o tercera etapa de mysis, las larvas también se alimentan con una mezcla de huevo y camarón en partículas de 100-150 µ, nauplios de Artemia o alimentos microparticulados. Se han logrado resultados exitosos de cría larval sin la inclusión de nauplios de Artemia, que son caros, pero se obtiene una mejor tasa de supervivencia cuando se emplea la Artemia en la alimentación.
Criadero
Las postlarvas (PL5) procedentes de los tanques de cría larva se transfieren a tanques de cría con capacidad de 10 toneladas donde alcanzan el estadío PL20. A partir de PL5 se utilizan dietas artificiales con el objeto de reducir el deterioro de la calidad del agua. A una densidad de estabulación de 75 nauplii/litro, la supervivencia se estima en 75 por ciento de nauplio a PL5 y de 80 por ciento de PL5 a PL20. Se pueden obtener doce ciclos larvales en 8 meses. Las postlarvas PL20 pueden estabularse directamente en estanques de engorda para su cultivo.
Técnicas de engorda
Las prácticas de cultivo del camarón incluyen la tradicional, la extensiva, extensiva modificada, semi-intensiva o intensiva. Las prácticas tradicionales de cultivo se siguen realizando en estanques de marea sobre la costa suroccidental de la India. El cultivo semi-intensivo comercial fue adoptado en países del Medio Oriente y del Golfo Pérsico. El cultivo semi-intensivo de P. indicus en algunas partes de la Inda ha sido reemplazado por P. monodon debido a su mayor rentabilidad económica.
Tradicional
Este sistema de cultivo de camarón, el cual involucra la captura y mantenimiento de juveniles que ingresan al estanque por efectos de la marea, se practica en Bangladesh, India, Indonesia, Myanmar, Filipinas y Viet Nam. En la costa suroccidental de la India, los arrozales de 0,5 a 10 ha sujetos a la influencia de las mareas, se estabulan automáticamente con semillas silvestres de distintas variedades de camarón y peces de noviembre a abril. Estos campos se utilizan por temporadas para monocultivo durante el monzón (junio a septiembre). Los campos mucho más grandes con superficies de 2 a 75 ha y que poseen áreas más profundas, donde el cultivo de arroz es imposible, también se usan para la engorda de camarón a lo largo del año. Los camarones se alimentan naturalmente en los estanques y la producción varía de 400 a 900 kg/ha/año. El P. Indicus conforma 36-43 por ciento del total de la producción de camarón.
Extensivo modificado
Se construyen estanques de 1 a 2 ha con instalaciones independientes de entrada y salida de agua en sitios elevados, lo que permite el drenado total del estanque. Los estanques se fertilizan con fertilizantes orgánicos e inorgánicos, y se estabulan con semilla a razón de 60 000-100 000 organismos/ha. Los camarones se alimentan a partir de alimentos naturales favorecidos por la fertilización del estanque, y complementados con dietas artificiales. El recambio de agua de 10-15 por ciento se realiza diariamente. Se obtiene una producción de 1 000 a 2 500 kg/ha/cosecha en 3 ó 4 meses de cultivo.
Semi-intensivo
Los estanques semi-intensivos se estabulan con semillas producidas en incubadoras a razón de 20 a 25 PL/m². El recambio de agua se realiza con regularidad por medio de bombas. Se utilizan 4-6 aireadores/ha para mantener los niveles deseados de oxígeno disuelto. Se obtienen niveles de producción de 2 500 a 5 000 kg/ha/cosecha.
Intensivo
El cultivo intensivo de P. indicus se introdujo por primera vez cuando se inició el cultivo comercial de camarón a finales de los 80. La densidad de estabulación adoptada fue de 50-100 PL/m². La alimentación con dietas artificiales se realiza 4-5 veces al día. Se practica una intensa aireación y recambio de agua para minimizar el deterioro ambiental. El nivel de producción obtenido varía ebtre 10 000 a 20 000 kg/ha/año, mientras que un empresario declaró una producción de 12 000 kg/ha/cosecha en el sureste indio. Este sistema ya no se practica en la India. Sin embargo, los sistemas intensivos se emplean en Arabia Saudita; una compañía privada ha reportado una producción de 13 500 toneladas de P. indicus de un área total de estanques de 2 800 ha.
Suministro de alimento
En India los camaronicultores usan alimentos comerciales manufacturados localmente (no formulados específicamente para esta especie), así como alimentos importados formulados para Penaeus monodon. Algunos camaronicultores preparan sus propios alimentos, pero son menos nutritivos. El costo de los alimentos importados es más alto. En Arabia Saudita, la Compañía Camaronera Nacional prepara alimentos específicamente formulados para Penaeus indicus ya que cultiva exclusivamente esta especie.
Técnicas de cosecha
En el cultivo tradicional, la cosecha comienza dos meses después de la estabulación y se lleva a cabo del atardecer al amanecer de 7 a 8 días, alrededor de los periodos de luna llena y luna nueva. Se utilizan redes cónicas cerradas, colocadas en las compuertas durante la marea baja. La cosecha final del cultivo extensivo de realiza a los 3 a 4 meses de engorda. Se drena el agua durante la marea baja y el nivel se reduce aún más por bombeo, utilizando equipos móviles con motor de diesel. Los camarones restantes se cosechan con atarrayas. En los sistemas extensivos modificados, así como en los semi-intensivos, la cosecha se lleva a cabo drenando completamente los estanques, los camarones escapan por la de salidacompuerta y ahí se recolectan en bolsas de red. El resto de la producción se cosecha a mano. En Arabia Saudita, se utilizan técnicas mecanizadas de cosecha.
Manipulación y procesamiento
Se lavan los camarones, se limpian y pesan inmediatamente después de la cosecha, antes de transferirlos a agua fría a 0 ºC. Las cajas rectangulares en donde se colocan son transportadas a las plantas procesadoras en camiones insulados. En las plantas procesadoras, los camarones se limpian y separan y clasifican en varias tallas y categorías para cumplir con los requisitos de exportación. Dependiendo de los requisitos del mercado, los camarones se pueden procesar en varias maneras, tales como marquetas congeladas, listos para comer, fríos enteros, IQF (congelación criogénica individual), y productos preparados, los cuales son exportados en buques contenedores o por aire. Como parte de una estrategia de mercadeo mundial, los principales procesadores y exportadores han adoptado sistemas de control de calidad como HACCP e ISO.
Costos de producción
Los costos de producción dependen del sitio, el tipo de sistema de cultivo, la escala de la producción, el número de ciclos productivos anuales, la incidencia de enfermedades, etc. El costo de la producción promedio de semilla en India en 2000 se estimó en 1,6 USD/1 000. El costo del camarón adulto producido en un sistema extensivo modificado fue estimado en 1996 en 4,20 USD/kg pero puesto que esta especie no se cultiva comercialmente en la India (únicamente extensivamente), no se dispone de estimaciones actualizadas. Los costos de producción para esta especie cultivada en Arabia Saudita, no se encuentran disponibles.
Enfermedades y medidas de control
Las principales enfermedades de esta especie se muestran en la siguiente tabla. Las infecciones virales no pueden ser tratadas con medicamentes, pero se manejan monitoreando los patógenos virales en reproductores y postlarvas mediante la técnica PCR y adoptando buenas prácticas de cultivo, tales como estabulación regulada, protocolos de alimentación y una gestión efectiva de los estanques. Sin embargo, puede ocurrir la presencia de virus por cambios repentinos en la calidad del agua y un entorno pobre en el fondo de los estanques.
En algunos casos se han utilizado antibióticos y otros fármacos, pero su inclusión en esta tabla no implica una recomendación de la FAO.
Expertos en patologías
Se puede obtener asistencia de las siguientes fuentes:
En algunos casos se han utilizado antibióticos y otros fármacos, pero su inclusión en esta tabla no implica una recomendación de la FAO.
| ENFERMEDAD | AGENTE | TIPO | SÍNDROME | MEDIDAS |
| Mancha blanca. También conocido como WSBV, WSSV o virus Whispo | Parte del síndrome de mancha blanca Baculovirus complex | Virus | Letargo; menor consumo de alimentos; color rojizo con manchas blancas en la cutícula; mortandad en 3 a 10 días | Monitoreo de PCR en estadíos de reproductores, nauplios, PL y engorda; evitar alimentos frescos, minimizar o evitar el recambio de agua para prevenir que los virus entren al estanque; tratar estanques o criaderos infectados con 200 ppm de cloro, desinfectar equipo asociado |
| Polyhedrosis Baculovirosis nuclear. También conocida como la enfermedad de Monodon baculovirus (MBV) | Baculovirus | Virus | Letargo; anorexia; fijación de protozoarios epicomensales | Diagnósticos basados en ADN utilizando materia fecal de los reproductores silvestres; lavar a conciencia huevos y nauplios |
| Síndrome del caparazón flojo | No identificado | No identificado; se sospecha toxina de alga | Menor alimentación y crecimiento, letargo; caparazón flojo con espacio entre cutícula y músculo; mortandad | Buena administración del estanque |
| Enfermedad de algodón del camarón | Protozoarios | Microsporidios | Opacidad blancuzca en musculatura; menor alimentación (no es una enfermedad grave) | Eliminar camarones infectados del estanque |
Expertos en patologías
Se puede obtener asistencia de las siguientes fuentes:
- Dr. K.K. Vijayan, Physiology, Nutrition & Pathology Division, CMFRI, Cochin-682018, India (Tel: +91 484 239 4867)
E-mail: [email protected]
- Dr. I.S. Bright Singh, Centre for Fish Diseases Diagnosis & Management, CUSAT, Cochin-682016, India (Tel: +91 484-238 1120)
E-mail: [email protected]
ESTADÍSTICAS
Estadísticas de producción
Producción de acuicultura global de Penaeus indicus
(FAO Estadísticas pesqueras)
(FAO Estadísticas pesqueras)

Mercado y comercio
Productos
Los principales productos de exportación a Japón, Estados Unidos de América, la Unión Europea y el Medio Oriente son congelados (con cabeza, sin cabeza y pelados congelados, IQF y AFD), fríos, junto con varios productos de valor agregado, tales como curados de camarón, cortes, listos para cocinar, empanizados y al ajillo. Las tallas que no son apropiadas para la exportación se venden en el mercado doméstico.
Precios y estadísticas de mercado
El camarón blanco obtiene un precio relativamente más bajo que el Penaeus monodon. Mientras que el precio promedio C&F para el P. monodon pequeño y sin cabeza (talla 21/25) en el mercado estadounidense fue de 7-13 USD/kg (2001-2004), el precio promedio del camarón blanco en 2004 fue de 5,5 USD/kg.
Regulaciones de mercado
Los estándares sanitarios son muy altos en todos los países importadores, especialmente respecto a los residuos de antibióticos y químicos. El mercado de la Unión Europea tiene especificaciones aún más altas (tolerancia cero). El mercado estadounidense obliga a los estándares HACCP o Evaluación Sensorial al tiempo que impone regulaciones adicionales sobre tarifas antidumping de camarón importado y la aplicación de Artefactos Excluidores de Tortugas (TEDs por sus siglas en inglés) por parte de los barcos camaroneros en los países exportadores.
Los principales productos de exportación a Japón, Estados Unidos de América, la Unión Europea y el Medio Oriente son congelados (con cabeza, sin cabeza y pelados congelados, IQF y AFD), fríos, junto con varios productos de valor agregado, tales como curados de camarón, cortes, listos para cocinar, empanizados y al ajillo. Las tallas que no son apropiadas para la exportación se venden en el mercado doméstico.
Precios y estadísticas de mercado
El camarón blanco obtiene un precio relativamente más bajo que el Penaeus monodon. Mientras que el precio promedio C&F para el P. monodon pequeño y sin cabeza (talla 21/25) en el mercado estadounidense fue de 7-13 USD/kg (2001-2004), el precio promedio del camarón blanco en 2004 fue de 5,5 USD/kg.
Regulaciones de mercado
Los estándares sanitarios son muy altos en todos los países importadores, especialmente respecto a los residuos de antibióticos y químicos. El mercado de la Unión Europea tiene especificaciones aún más altas (tolerancia cero). El mercado estadounidense obliga a los estándares HACCP o Evaluación Sensorial al tiempo que impone regulaciones adicionales sobre tarifas antidumping de camarón importado y la aplicación de Artefactos Excluidores de Tortugas (TEDs por sus siglas en inglés) por parte de los barcos camaroneros en los países exportadores.
ESTATUS Y TENDENCIAS
Investigación
Las siguientes áreas requieren investigación intensiva:
En los países asiáticos, el cultivo de camarón se centraba en el camarón tigre Penaeus monodon. Sin embargo, la producción se ha visto afectada por varias causas, incluyendo enfermedades virales, falta de progenitores, barreras comerciales y competencia de mercado. Las especies de camarón blanco, tales como Penaeus indicus, fueron ignoradas, aunque se pudieran lograr altas tasas de producción. Sin embargo, la República Islámica del Irán y otros países del Medio Oriente prefieren cultivar esta especie por su capacidad de crecer en condiciones de hipersalinidad, por su patrón de crecimiento de largo plazo y por la simplicidad para la producción de semillas en incubadoras o laboratorios. Varios países asiáticos cambiaron a Litopenaeus vannamei cuando surgieron problemas con el P. monodon, ya que la domesticación y tecnología de cultivo son más sencillas; también se puede lograr una producción mayor, reduciendo los costos de producción de cultivo. Se anticipa una expansión del cultivo de P. indicus en la República Islámica del Irán y Arabia Saudita, pero no en otros países de Asia.
Mercado
El mercado futuro será para camarón orgánico y algunas compañías privadas en países como Arabia Saudita ya se han embarcado en la producción de P. indicus de alta calidad libre de antibióticos. Los países importadores pueden imponer estándares de calidad más severos, certificación de seguridad alimentaria y etiquetado ecológico.
Las siguientes áreas requieren investigación intensiva:
- Manejo eficiente del agua en sistemas cerrados de engorda.
- Reproducción y domesticación selectiva de reproductores SPF genéticamente mejorados.
- Estudios sobre síndrome de caparazón flojo y protocolos de tratamiento y manejo efectivo contra virus de camarón.
- Substitución de harina de pescado con ingredientes alimenticios ecológicos.
En los países asiáticos, el cultivo de camarón se centraba en el camarón tigre Penaeus monodon. Sin embargo, la producción se ha visto afectada por varias causas, incluyendo enfermedades virales, falta de progenitores, barreras comerciales y competencia de mercado. Las especies de camarón blanco, tales como Penaeus indicus, fueron ignoradas, aunque se pudieran lograr altas tasas de producción. Sin embargo, la República Islámica del Irán y otros países del Medio Oriente prefieren cultivar esta especie por su capacidad de crecer en condiciones de hipersalinidad, por su patrón de crecimiento de largo plazo y por la simplicidad para la producción de semillas en incubadoras o laboratorios. Varios países asiáticos cambiaron a Litopenaeus vannamei cuando surgieron problemas con el P. monodon, ya que la domesticación y tecnología de cultivo son más sencillas; también se puede lograr una producción mayor, reduciendo los costos de producción de cultivo. Se anticipa una expansión del cultivo de P. indicus en la República Islámica del Irán y Arabia Saudita, pero no en otros países de Asia.
Mercado
El mercado futuro será para camarón orgánico y algunas compañías privadas en países como Arabia Saudita ya se han embarcado en la producción de P. indicus de alta calidad libre de antibióticos. Los países importadores pueden imponer estándares de calidad más severos, certificación de seguridad alimentaria y etiquetado ecológico.
PRINCIPALES ASUNTOS
En años recientes, el cultivo del camarón ha generado una discusión y debate considerable sobre su sustentabilidad e impacto ambiental. Los principales temas son:
Recomendaciones
Los costos de producción en la India deberán ser reducidos y se deberán promover esfuerzos para comercializar el camarón cultivado en los mercados domésticos a precios razonables. Prácticas de cultivo cooperativo, tales como granjas satélites, ayudarían a garantizar una administración apropiada de los sistemas de engorda, con planes de compra de camarón a pequeños productores. La investigación deberá enfocarse en el desarrollo genético de stocks de reproductores SPF y SPR mejorados genéticamente para la producción de camarones saludables y de rápido crecimiento.
- Contaminación de mantos acuíferos por el agua de drenaje de los estanques.
- Pérdida de tierras agrícolas por salinización.
- Destrucción de manglares y mal uso de pantanos.
- Conflictos sociales con otros usuarios de estos recursos.
- Mayor dependencia de la harina de pescado para las dietas de los camarones.
- Pérdida de biodiversidad por una mayor explotación de semilla y reproductores silvestres.
- Introducción de especies exóticas.
Recomendaciones
Los costos de producción en la India deberán ser reducidos y se deberán promover esfuerzos para comercializar el camarón cultivado en los mercados domésticos a precios razonables. Prácticas de cultivo cooperativo, tales como granjas satélites, ayudarían a garantizar una administración apropiada de los sistemas de engorda, con planes de compra de camarón a pequeños productores. La investigación deberá enfocarse en el desarrollo genético de stocks de reproductores SPF y SPR mejorados genéticamente para la producción de camarones saludables y de rápido crecimiento.
Prácticas de acuicultura responsable
Debido a la rápida expansión del cultivo de camarón, se desarrolló una mayor conciencia del impacto ambiental potencial. Por ejemplo, la India siguió las instrucciones de su Corte Suprema (ver Gazette Notification No. 76 con fecha 6.2.1997), el cual establecía una Autoridad Acuícola para garantizar las prácticas acuícolas responsables. La autoridad recibió la responsabilidad de otorgar licencias a camaronicultores y la preparación de lineamientos que promuevan el cultivo sustentable. Como otro ejemplo, Tailandia ha cumplido con el concepto de acuicultura establecido en el Art. 9 del Código de Conducta de la FAO. Sin embargo, la implementación de certificados y sistemas de etiquetado ecológico puede llevarse a cabo más lentamente por las dificultades en el rastreo del origen de productos calificados de granjas y criaderos pequeños.
REFERENCIAS
Bibliograf�a
| Anonymous. 1978. Larval development of Indian penaeid prawns. Coastal aquaculture, marine prawn culture, Part 1. CMFRI Bulletin 28, Central Marine Fisheries Research Institute, Kochi, India. 90 pp. |
| Anonymous. 1991. A manual on shrimp farming. The Marine Products Export Development Authority, Kochi, India. 47 pp. |
| Anonymous. 2001. Shrimp aquaculture and the environment- an environment impact assessment report. Aquaculture Authority of India, Government of India, Chennai, India. 114 pp. |
| Devaraj. M. 1996. Small scale shrimp hatchery. Technology Transfer Series 9. Central Marine Fisheries Research Institute, Kochi. 15 pp. |
| Devaraj. M. 1996. Environment-friendly shrimp farming. Technology Transfer Series.10A. Central Marine Fisheries Research Institute, Kochi, India. 59 pp. |
| Flegel, T.W. 2006. Detection of major penaeid shrimp viruses in Asia, a historical perspective with emphasis on Thailand. Aquaculture, 258:1-33. |
| Maheswarudu, G., Neelakanta Pillai, N. & Manmadhan Nair, K.R. 2000. Broodstock development and spawning in Penaeus indicus. pp. 714-721 In V.N. Pillai & N.G. Menon (eds), Marine Fisheries Research and Management. Central Marine Fisheries Research Institute, Kochi, India. |
| Mohamed, K.H. 1970. Synopsis of biological data on the Indian prawn Penaeus indicus H. Milne Edwards, 1837. FAO Fisheries Synopsis No. 94. 20 pp. |
| Neelakanta Pillai, N., Maheswarudu, G. & Manmadhan Nair, K.R. 2000. Seed production and hatchery management of Penaeus indicus. pp. 704-713 In V.N. Pillai & N.G. Menon (eds), Marine Fisheries Research and Management. Central Marine Fisheries Research Institute, Kochi, India. |
| Unnithan, K. A. 1985. A guide to prawn farming in Kerala. CMFRI Special Publication 21. 92 pp. |
| Vijayan, K.K., Alvandi, S.V., Rajendran, K.V. & Alagarswami, K. 1995. Prevalence and histopathology of Monodon Baculovirus (MBV) infection in Penaeus monodon and P. indicus in shrimp farms in the South-East coast of India. Asian Fisheries Science, 8:277-272. |
