
|
|||||||||
 |
|
||||||||
FAO. 2009.
Ruditapes philippinarum. In Cultured aquatic species fact sheets. Text by
Goulletquer, P.
Edited and compiled by Valerio Crespi and Michael New. CD-ROM (multilingual). |
|||||||||
IDENTIDAD
Rasgos biológicos
Concha sólida, equivalva; no equilateral con picos en la mitad anterior; con un perfil ovoidal. La fijación del ligamento no es oculta, con un cuerpo arqueado elíptico de color café que se extiende casi hacia atrás casi hasta el margen posterior. La lúnula es elongada con forma acorazonada, no bien delineada, con bordes radiales finos de color café oscuro. El escudo se reduce a un mero borde en la región posterior del ligamento. Estructura de costillas radiales y hendiduras concéntricas, éstas se vuelven afiladas en las partes anterior y posterior de la concha, convirtiendo la superficie pronunciadamente decusada (las crestas se cruzan transversalmente en forma de “x”). Los anillos de crecimiento son notorios. Tres dientes cardinales en cada valva, el central de la valva izquierda y el central y el posterior de la valva derecha son bífidos. No posee dientes laterales. El seno palial es relativamente profundo, aunque no se extiende más allá del centro de la concha; deja un espacio en forma de cuña entre su limbo inferior y la línea palial. El margen es suave. Notablemente variable en color y patrón: blanca, amarilla o café clara, en ocasiones con rayas, manchas o líneas zigzagueantes de color café más oscuro, ligeramente pulida; el interior de la concha es pulida de color blanca o con un tinte anaranjado, ocasionalmente de color púrpura en la región próxima al umbo.
Galería de imágenes
 Cosecha de almeja japonesa, empleando pequeño tractor, en pequeñas parcelas y fondo suave |
 Cosecha de almeja japonesa, empleando tractor equipado con cuchilla y banda transportadora (fondo rígido) |
 Siembra de almeja bajo malla, antes de cubrir con la parte derecha de la red |
PERFIL
Antecedentes históricos
La almeja japonesa (también conocida como almeja de cuello corto o almeja manila) es una especie de subtropical a boreal de latitudes bajas del Pacífico occidental y se distribuye en zonas templadas de Europa. Las poblaciones silvestres se encuentran en Filipinas, Mares del Sur y del Este de China, Mar Amarillo, Mar de Japón, Mar de Okhotsk e Islas del Sur de Kuril. Su cultivo se inició en aquellas áreas donde se practicaban las actividades tradicionales de pesca, mediante la recolección de semilla silvestre.
De considerable valor comercial, la almeja japonesa se ha introducido a diversas regiones del mundo, en donde se ha establecido de manera permanente. Accidentalmente se introdujo a las costas del Pacífico de Norte América en la década de 1930, junto con la semilla del ostión japonés; la almeja japonesa se ha diseminado y arraigado desde California hasta Columbia Británica. Además de las pesquerías públicas, la producción de las incubadoras ha facilitado el cultivo de la almeja japonesa por la costa del Pacífico. La almeja japonesa también se transfirió desde Japón hasta aguas de Hawaii a principios del siglo XX, en donde habitan poblaciones silvestres. La sobrepesca y los rendimientos irregulares de almejas nativas (europeas) como la almeja fina (Ruditapes decussatus), generó la importación de R. philippinarum a las aguas europeas. Esta especie se introdujo en 1972 mediante la producción en incubadoras francesas. También se realizaron importaciones al Reino Unido procedentes de Oregon (Estados Unidos de América) y siguieron numerosas transferencias a diversos sitios de Europa con el objetivo de su producción por acuicultura (Portugal, Irlanda, España e Italia). Además, las pruebas de acuicultura provocaron importaciones de semilla a la Polinesia Francesa, las Islas Vírgenes, Noruega, Alemania, Bélgica, Túnez, Marruecos e Israel. Tras la producción acuícola en incubadoras, basada en el desarrollo de la actividad en Europa durante la década de 1980, la reproducción natural produjo una expansión geográfica de las poblaciones naturales, particularmente en Italia, Francia e Irlanda, en donde la almeja japonesa mostró ser más resistente y de crecimiento más rápido que la especie endémica R. decussatus. Consecuentemente, las poblaciones de R. philippinarum son las que contribuyen de mayor manera en los desembarques de almeja en Europa, y son el centro de pesca pública intensiva, compitiendo con los productos acuícolas en diversas áreas de producción.
De considerable valor comercial, la almeja japonesa se ha introducido a diversas regiones del mundo, en donde se ha establecido de manera permanente. Accidentalmente se introdujo a las costas del Pacífico de Norte América en la década de 1930, junto con la semilla del ostión japonés; la almeja japonesa se ha diseminado y arraigado desde California hasta Columbia Británica. Además de las pesquerías públicas, la producción de las incubadoras ha facilitado el cultivo de la almeja japonesa por la costa del Pacífico. La almeja japonesa también se transfirió desde Japón hasta aguas de Hawaii a principios del siglo XX, en donde habitan poblaciones silvestres. La sobrepesca y los rendimientos irregulares de almejas nativas (europeas) como la almeja fina (Ruditapes decussatus), generó la importación de R. philippinarum a las aguas europeas. Esta especie se introdujo en 1972 mediante la producción en incubadoras francesas. También se realizaron importaciones al Reino Unido procedentes de Oregon (Estados Unidos de América) y siguieron numerosas transferencias a diversos sitios de Europa con el objetivo de su producción por acuicultura (Portugal, Irlanda, España e Italia). Además, las pruebas de acuicultura provocaron importaciones de semilla a la Polinesia Francesa, las Islas Vírgenes, Noruega, Alemania, Bélgica, Túnez, Marruecos e Israel. Tras la producción acuícola en incubadoras, basada en el desarrollo de la actividad en Europa durante la década de 1980, la reproducción natural produjo una expansión geográfica de las poblaciones naturales, particularmente en Italia, Francia e Irlanda, en donde la almeja japonesa mostró ser más resistente y de crecimiento más rápido que la especie endémica R. decussatus. Consecuentemente, las poblaciones de R. philippinarum son las que contribuyen de mayor manera en los desembarques de almeja en Europa, y son el centro de pesca pública intensiva, compitiendo con los productos acuícolas en diversas áreas de producción.
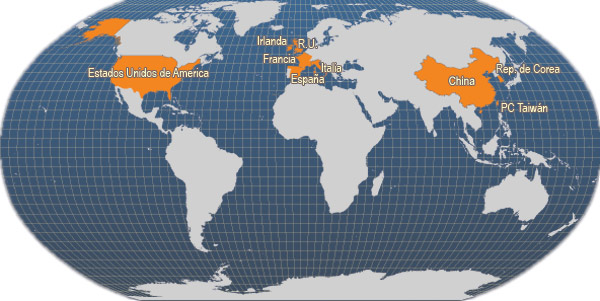
Principales países productores

Principales países productores de Ruditapes philippinarum (FAO Estadísticas pesqueras, 2006)
Hábitat y biología
La almeja japonesa (Ruditapes philippinarum) es originaria de Japón, con una amplia distribución en los Océanos Índico y Pacífico desde Pakistán hasta la Federación Rusa (Islas Kuril). Subsecuentemente se ha introducido a lo largo de la costa del Pacífico de Norteamérica, las islas de Hawaii y, en los últimos 20 años, por la costa europea desde el Reino Unido hasta la cuenca mediterránea.
La almeja japonesa es estrictamente gonocórica y sus gónadas están representadas por un tejido difuso estrechamente unido al sistema digestivo. El período de reproducción varía, de acuerdo al área geográfica; la reproducción generalmente ocurre con temperaturas entre 20 y 25 °C. Se observa un período de descanso sexual desde finales del otoño hasta principios del invierno. La gametogénesis en el medio natural dura de 2 a 5 meses, seguidos por la reproducción. Un segundo evento de reproducción puede ocurrir en la misma temporada, de 2 a 3 meses más tarde. La fase de recuperación pre invernal facilita la acumulación energética mediante la filtración de agua de mar aún rica en materia orgánica y fitoplancton. La temperatura y la alimentación son dos parámetros que afectan la gametogénesis, que puede iniciar a una temperatura de entre 8 y 10 °C y se acelera al elevarse la temperatura del agua marina. Su duración se reduce de 5 a 2 meses entre 14 y 24 °C. En este rango de temperatura, la almeja japonesa está lista para la reproducción. Aunque la temperatura óptima es entre 20 y 22 °C, 12 °C es el límite inferior en el cual la especie no puede reproducirse eficientemente. La disponibilidad de alimento influye en la cantidad de gametos producidos. El desarrollo larvario dura de 2 a 4 semanas antes del desove. La talla de fijación es entre 190 y 235 µm de longitud de concha. Muchos factores externos regulan que la fijación larval sea exitosa en el medio natural, tales como temperatura, salinidad y corrientes. El movimiento larvario depende principalmente del arrastre que producen las corrientes, mareas y el viento. La colocación de grava y pequeñas piedras contribuyen a facilitar el reclutamiento en aguas estáticas naturales. Las larvas se fijan al adherir su glándula del biso a una piedra o pedazo de concha.
La almeja japonesa es estrictamente gonocórica y sus gónadas están representadas por un tejido difuso estrechamente unido al sistema digestivo. El período de reproducción varía, de acuerdo al área geográfica; la reproducción generalmente ocurre con temperaturas entre 20 y 25 °C. Se observa un período de descanso sexual desde finales del otoño hasta principios del invierno. La gametogénesis en el medio natural dura de 2 a 5 meses, seguidos por la reproducción. Un segundo evento de reproducción puede ocurrir en la misma temporada, de 2 a 3 meses más tarde. La fase de recuperación pre invernal facilita la acumulación energética mediante la filtración de agua de mar aún rica en materia orgánica y fitoplancton. La temperatura y la alimentación son dos parámetros que afectan la gametogénesis, que puede iniciar a una temperatura de entre 8 y 10 °C y se acelera al elevarse la temperatura del agua marina. Su duración se reduce de 5 a 2 meses entre 14 y 24 °C. En este rango de temperatura, la almeja japonesa está lista para la reproducción. Aunque la temperatura óptima es entre 20 y 22 °C, 12 °C es el límite inferior en el cual la especie no puede reproducirse eficientemente. La disponibilidad de alimento influye en la cantidad de gametos producidos. El desarrollo larvario dura de 2 a 4 semanas antes del desove. La talla de fijación es entre 190 y 235 µm de longitud de concha. Muchos factores externos regulan que la fijación larval sea exitosa en el medio natural, tales como temperatura, salinidad y corrientes. El movimiento larvario depende principalmente del arrastre que producen las corrientes, mareas y el viento. La colocación de grava y pequeñas piedras contribuyen a facilitar el reclutamiento en aguas estáticas naturales. Las larvas se fijan al adherir su glándula del biso a una piedra o pedazo de concha.
PRODUCCIÓN
Expertos en patología
Se puede obtener asistencia a través de los siguientes recursos:
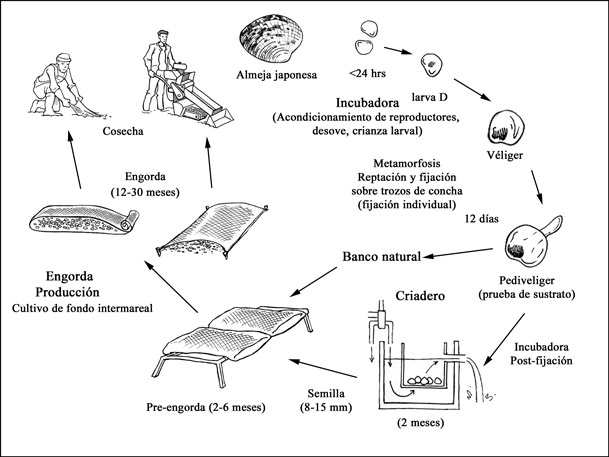
Ciclo de producción

Ciclo de producción de Ruditapes philippinarum
Sistemas de producción
El ciclo de producción empieza con la etapa reproductiva y la producción de semilla. La semilla se puede obtener mediante captación de semilla silvestre o de producción en incubadora. La mayor parte de almeja japonesa es cultivada en zonas intermarealesde fondo, empleando semilla silvestre o con productos de incubadora (cuya talla es de 2-3 mm).
Suministro de semilla silvestre
Además de la colorida almeja Ruditapes variegata, la almeja japonesa R. philippinarum es una de las especies predominantes y tradicionales en China, en donde se cultiva principalmente a partir de semilla silvestre recolectada en playas lodosas y zonas arenosas. En este país, la recolección de semilla incluye la selección y preparación de las camas de recolección de semilla, erradicación de depredadores y mantenimiento de rutina. Se han desarrollado técnicas para incrementar la captación de semilla: ellas consisten en estanques someros (hasta de varias hectáreas) construidos en la zona intermareal baja, de donde se retiran todos los competidores: algas y depredadores, y el fondo es emparejado. Estos estanques pueden inocularse con Chaetoceros, que constituye un alimento adecuado para las larvas y postlarvas. Cada estanque puede utilizarse para criar de dos a tres camadas por año. Se pueden criar ente 75 y 150 millones de semillas de almeja (0,5 cm) por ha. Estas almejas crecen hasta 1,5 cm hacia el mes de mayo del siguiente año, cuando se trasplantan a una densidad de 1,8 millones/ha durante un año más para alcanzar una talla de 3,5 cm que es su talla comercial (19-45 toneladas/ha).
En aguas europeas, el suministro de semilla proviene tanto de la producción en incubadoras como de la captura de semilla silvestre. La disponibilidad de semilla silvestre es resultado del patrón invasivo de esta especie en áreas donde se cultivaba previamente utilizando semilla producida en incubadoras. En contraste, la mayor parte del abasto de semilla en Norteamérica proviene de la producción en incubadoras.
Producción en incubadoras
Las principales actividades consisten en el acondicionamiento de los reproductores para facilitar la gametogénesis; desove y cría larvaria hasta su metamorfosis; y la cría de juveniles hasta un tamaño adecuado, tanto en criaderos o directamente en el mar.
El acondicionamiento de los pies de cría lleva de 30 a 40 días a 20 °C. El desove se induce mediante estímulos de golpes térmicos o al incorporar gotas de esperma o mediante su “ordeña”. Los huevos fertilizados se filtran por un cedazo de 40 µm y se conservan en contenedores de 10 litros hasta la etapa de larva véliger. Las larvas se tamizan y distribuyen en contenedores de 3 000/l. A las larvas se les alimenta diariamente durante la primera semana con 30 céluas/µl, después cada tercer día hasta alcanzar la metamorfosis larvaria (2 semanas). La salinidad durante la fase de cría debe ser de entre 24 y 35‰ (el rango de tolerancia es de entre 13,5 y 35‰). La temperatura ideal es entre 15 y 28 °C para el crecimiento, aún cuando la especie puede sobrevivir entre los 0 ° y 35 °C durante períodos breves de tiempo. En esta etapa las larvas pediveliger de la almeja ya pueden prepararse para embarque de la siguiente manera: tras un proceso de tamiz y conteo, se colocan en material de embalaje (nytex o papel de filtro de café), se envuelven en varias capas de toallas de papel para conservar la humedad, se colocan en cajas aislantes empacadas con hielo (sin que éste quede en contacto con las larvas). Alternativamente, las larvas pediveliger se colocan en tanques de sedimentación o charolas de microcrianza, construidas de malla de nylon y un sistema de flujo con recirculación del agua, con un recambio frecuente de ella (vgr. e.g., camas de agua con flujo descendente). Cada vez que las almejas se saquen del agua, debe cuidarse que no se sequen o que se eleve suba su temperatura.
La cría de almejas japonesas en incubadoras requiere la producción de especies apropiadas de micro algas para su alimentación. Generalmente las especies de fitoplancton que se emplean son flagelados tales como Isochrysis galbana, Pavlova lutherii y Tetraselmis suecica o Platymonas sp. La combinación de flagelados y diatomeas tales como Skeletonema costatum, Chaetoceros calcitrans, C. gracilis y Thalassiosira pseudonana constituyen una dieta balanceada que facilita la gametogénesis y desarrollo larvario. El requerimiento de alimento depende de la densidad larvaria.
Si bien las almejas tienen una concha protectora, ésta puede romperse si no se maneja cuidadosamente durante los procesos de criba y selección.
Un sistema de cría, utilizando flujo de surgencia puede utilizarse para pre-engordar semilla hasta una talla de 10-15 mm. Almejas ligeramente mayores (6-7 mm) en densidades de 3 000/m² se colocan sobre el fondo marino en bolsas de malla de 4 mm (1,5 m x 2 m). Otras prácticas de pre-engorda, incluyen la colocación de semilla de 4-5 mm en densidades de 10 000/m² en marcos de madera cubiertos con redes de plástico, sobrepuestas e inmersas bajo el agua (en Italia) o en marcos de madera cubiertos por malla, o en bolsas de malla en caballetes cerca del área de marea baja viva (en Irlanda). Las densidades se van reduciendo progresivamente conforme aumenta su tamaño. Durante el período de cría, las instalaciones para engorda deberán limpiarse, las almeja se seleccionarán y se eliminarán a los depredadores tales como el cangrejo. Si bien el cultivo en charolas puede utilizarse para las primeras etapas de engorda, las almejas crecen mejor en el suelo. En Norteamérica, se utilizan sistemas de surgencia (upwellers) flotantes tales como el FLUPSY (por sus siglas en inglés), una estructura de estantes que sostiene diversos contenedores con un canal central por el cual se impulsa el agua, utilizando una hélice o una rueda de molino). Las almejas deberán graduarse por tallas para garantizar que todos los animales sean de tamaño similar; de lo contrario, las almejas grandes pueden dejar fuera de competencia a las menores, generando un crecimiento retardado.
Cuando la concha alcanza 10-15 mm, las almejas están listas para sembrarse en el sustrato. La fase de engorda suele realizarse con mayor éxito en zonas intermareales, protegidos de vientos extremos y de la acción del oleaje y las mareas. Alternativamente, pueden utilizarse estanques ostrícolas de 400 m² para el cultivo de la almeja hasta alcanzar su talla comercial. Los sustratos apropiados para la etapa de engorda generalmente son la grava, arena, lodo y conchas. Si bien la almeja japonesa sobrevive en diversos suelos, un fondo demasiado blando limita el acceso y el tipo de quipo utilizado para la siembra, cría y cosecha. Previamente a la siembra, el área debe prepararse adecuadamente y eliminarse todos los depredadores. El sistema de cultivo en parcelas, utiliza tiras de malla desplegada sobre las almejas sembradas y acamellonadas o enterradas a lo largo de las orillas de la parcela para limitar la depredación por cangrejos y aves.
El crecimiento y la supervivencia están directamente relacionados con la densidad de siembra. Las almejas de entre 10 y 15 mm se siembran a densidades de entre 200 y 300/m² y simultáneamente se cubren con un red de malla de 4 mm (de 1,5 m de ancho y 300 m de largo) para protegerlas de la excesiva depredación. En Europa, se ha diseñado una máquina sembradora, que simultáneamente coloca la red y siembra la semilla. Las placas deflectoras rellenan las zanjas, enterrando las orillas de la red. Las redes deben limpiarse para evitar organismos fijadores o epibiontes y sedimentos, asimismo se requiere monitorear para eliminar a los depredadores. Dependiendo de la capacidad productiva del sitio, las almejas crecerán hasta 40 mm en un período de entre 2 y 3 años.
En China, las semillas de almeja japonesa (5-10 mm) se siembran en densidad de 35 millones/ha, aunque la densidad se establece de acuerdo al tamaño de la semilla y tipo de sedimento. Generalmente las camas o bancos de almeja no se protegen con redes.
En China, las almejas se cosechan tras 10-16 meses de engorda al alcanzar los 30 mm o mayores. En aguas europeas y en Norteamérica, las almejas generalmente se cosechan tras un período de 16 a 30 meses de cría y de mayor talla de la concha (30-40 mm) para obtener un mejor precio de venta. En ambos casos, generalmente se recogen rastrillándolas o se cosechan mecánicamente. En Europa, la cosecha manual de almeja japonesa consiste en rastrillarlas para desenterrarlas del sustrato y llevarlas a la superficie. La cosecha mecánica se realiza mediante succión o con dragas-elevadores; un tractor equipado con banda transportadora lateral puede excavar y clasificar las almejas en fondos arenosos, cubriendo más de 200 m²/hr (>600 kg/hr).
Una vez cosechadas, las almejas se colocan en cajas o bolsas y se transportan para ser seleccionadas mecánicamente. Entonces se almacenan en húmedo para purgar grava y arena, previo a su procesamiento y comercialización. Pueden almacenarse en agua por más tiempo en las áreas intermareales, utilizando bolsas de malla de plástico, o en estanques o bien suspendidas de balsas de almacenamiento, hasta su venta.
Los costos de producción varían mucho, debido a diversos factores. Dependiendo de las características del sitio, las almejas pueden tardar entre 2 y 4 años para alcanzar una talla de mercado, lo que afecta el rendimiento general. La capacidad de carga local, la suavidad del suelo y los costos de los procedimientos operativos, tales como la preparación de parcelas de siembra, eliminación de depredadores, limpieza para evitar que las estructuras se atasquen en el lodo o por algas y la selección regular, son entre otros, los principales factores que afectan los costos totales de producción. Además, la selección de la técnica de cultivo influye de manera directa en los costos de producción. La talla de la semilla, cuando se adquiere de una incubadora, es otro aspecto fundamental. Los costos menores al adquirir semilla pequeña, pueden verse contrarrestados por una mayor tasa de mortalidad y mayores costos de operación (estructuras para cría de semilla); en contraste, la adquisición de semilla más grande es más cara por lo que se requieren mejores tasas de supervivencia para lograr un balance costo-beneficio. Las características del sustrato (arenoso versus fangoso) influyen en el proceso de cosecha y su eficiencia; por ejemplo, la cosecha mecánica es más fácil en fondos arenosos, mejorando el rendimiento. Todos estos factores deberán considerarse cuidadosamente en la planeación del cultivo de almeja, a fin de optimizar los costos de producción y seleccionar la estrategia de cultivo apropiada.
Suministro de semilla
Suministro de semilla silvestre
Además de la colorida almeja Ruditapes variegata, la almeja japonesa R. philippinarum es una de las especies predominantes y tradicionales en China, en donde se cultiva principalmente a partir de semilla silvestre recolectada en playas lodosas y zonas arenosas. En este país, la recolección de semilla incluye la selección y preparación de las camas de recolección de semilla, erradicación de depredadores y mantenimiento de rutina. Se han desarrollado técnicas para incrementar la captación de semilla: ellas consisten en estanques someros (hasta de varias hectáreas) construidos en la zona intermareal baja, de donde se retiran todos los competidores: algas y depredadores, y el fondo es emparejado. Estos estanques pueden inocularse con Chaetoceros, que constituye un alimento adecuado para las larvas y postlarvas. Cada estanque puede utilizarse para criar de dos a tres camadas por año. Se pueden criar ente 75 y 150 millones de semillas de almeja (0,5 cm) por ha. Estas almejas crecen hasta 1,5 cm hacia el mes de mayo del siguiente año, cuando se trasplantan a una densidad de 1,8 millones/ha durante un año más para alcanzar una talla de 3,5 cm que es su talla comercial (19-45 toneladas/ha).
En aguas europeas, el suministro de semilla proviene tanto de la producción en incubadoras como de la captura de semilla silvestre. La disponibilidad de semilla silvestre es resultado del patrón invasivo de esta especie en áreas donde se cultivaba previamente utilizando semilla producida en incubadoras. En contraste, la mayor parte del abasto de semilla en Norteamérica proviene de la producción en incubadoras.
Producción en incubadoras
Las principales actividades consisten en el acondicionamiento de los reproductores para facilitar la gametogénesis; desove y cría larvaria hasta su metamorfosis; y la cría de juveniles hasta un tamaño adecuado, tanto en criaderos o directamente en el mar.
El acondicionamiento de los pies de cría lleva de 30 a 40 días a 20 °C. El desove se induce mediante estímulos de golpes térmicos o al incorporar gotas de esperma o mediante su “ordeña”. Los huevos fertilizados se filtran por un cedazo de 40 µm y se conservan en contenedores de 10 litros hasta la etapa de larva véliger. Las larvas se tamizan y distribuyen en contenedores de 3 000/l. A las larvas se les alimenta diariamente durante la primera semana con 30 céluas/µl, después cada tercer día hasta alcanzar la metamorfosis larvaria (2 semanas). La salinidad durante la fase de cría debe ser de entre 24 y 35‰ (el rango de tolerancia es de entre 13,5 y 35‰). La temperatura ideal es entre 15 y 28 °C para el crecimiento, aún cuando la especie puede sobrevivir entre los 0 ° y 35 °C durante períodos breves de tiempo. En esta etapa las larvas pediveliger de la almeja ya pueden prepararse para embarque de la siguiente manera: tras un proceso de tamiz y conteo, se colocan en material de embalaje (nytex o papel de filtro de café), se envuelven en varias capas de toallas de papel para conservar la humedad, se colocan en cajas aislantes empacadas con hielo (sin que éste quede en contacto con las larvas). Alternativamente, las larvas pediveliger se colocan en tanques de sedimentación o charolas de microcrianza, construidas de malla de nylon y un sistema de flujo con recirculación del agua, con un recambio frecuente de ella (vgr. e.g., camas de agua con flujo descendente). Cada vez que las almejas se saquen del agua, debe cuidarse que no se sequen o que se eleve suba su temperatura.
La cría de almejas japonesas en incubadoras requiere la producción de especies apropiadas de micro algas para su alimentación. Generalmente las especies de fitoplancton que se emplean son flagelados tales como Isochrysis galbana, Pavlova lutherii y Tetraselmis suecica o Platymonas sp. La combinación de flagelados y diatomeas tales como Skeletonema costatum, Chaetoceros calcitrans, C. gracilis y Thalassiosira pseudonana constituyen una dieta balanceada que facilita la gametogénesis y desarrollo larvario. El requerimiento de alimento depende de la densidad larvaria.
Criadero
Si bien las almejas tienen una concha protectora, ésta puede romperse si no se maneja cuidadosamente durante los procesos de criba y selección.
Un sistema de cría, utilizando flujo de surgencia puede utilizarse para pre-engordar semilla hasta una talla de 10-15 mm. Almejas ligeramente mayores (6-7 mm) en densidades de 3 000/m² se colocan sobre el fondo marino en bolsas de malla de 4 mm (1,5 m x 2 m). Otras prácticas de pre-engorda, incluyen la colocación de semilla de 4-5 mm en densidades de 10 000/m² en marcos de madera cubiertos con redes de plástico, sobrepuestas e inmersas bajo el agua (en Italia) o en marcos de madera cubiertos por malla, o en bolsas de malla en caballetes cerca del área de marea baja viva (en Irlanda). Las densidades se van reduciendo progresivamente conforme aumenta su tamaño. Durante el período de cría, las instalaciones para engorda deberán limpiarse, las almeja se seleccionarán y se eliminarán a los depredadores tales como el cangrejo. Si bien el cultivo en charolas puede utilizarse para las primeras etapas de engorda, las almejas crecen mejor en el suelo. En Norteamérica, se utilizan sistemas de surgencia (upwellers) flotantes tales como el FLUPSY (por sus siglas en inglés), una estructura de estantes que sostiene diversos contenedores con un canal central por el cual se impulsa el agua, utilizando una hélice o una rueda de molino). Las almejas deberán graduarse por tallas para garantizar que todos los animales sean de tamaño similar; de lo contrario, las almejas grandes pueden dejar fuera de competencia a las menores, generando un crecimiento retardado.
Técnicas de engorda
Cuando la concha alcanza 10-15 mm, las almejas están listas para sembrarse en el sustrato. La fase de engorda suele realizarse con mayor éxito en zonas intermareales, protegidos de vientos extremos y de la acción del oleaje y las mareas. Alternativamente, pueden utilizarse estanques ostrícolas de 400 m² para el cultivo de la almeja hasta alcanzar su talla comercial. Los sustratos apropiados para la etapa de engorda generalmente son la grava, arena, lodo y conchas. Si bien la almeja japonesa sobrevive en diversos suelos, un fondo demasiado blando limita el acceso y el tipo de quipo utilizado para la siembra, cría y cosecha. Previamente a la siembra, el área debe prepararse adecuadamente y eliminarse todos los depredadores. El sistema de cultivo en parcelas, utiliza tiras de malla desplegada sobre las almejas sembradas y acamellonadas o enterradas a lo largo de las orillas de la parcela para limitar la depredación por cangrejos y aves.
El crecimiento y la supervivencia están directamente relacionados con la densidad de siembra. Las almejas de entre 10 y 15 mm se siembran a densidades de entre 200 y 300/m² y simultáneamente se cubren con un red de malla de 4 mm (de 1,5 m de ancho y 300 m de largo) para protegerlas de la excesiva depredación. En Europa, se ha diseñado una máquina sembradora, que simultáneamente coloca la red y siembra la semilla. Las placas deflectoras rellenan las zanjas, enterrando las orillas de la red. Las redes deben limpiarse para evitar organismos fijadores o epibiontes y sedimentos, asimismo se requiere monitorear para eliminar a los depredadores. Dependiendo de la capacidad productiva del sitio, las almejas crecerán hasta 40 mm en un período de entre 2 y 3 años.
En China, las semillas de almeja japonesa (5-10 mm) se siembran en densidad de 35 millones/ha, aunque la densidad se establece de acuerdo al tamaño de la semilla y tipo de sedimento. Generalmente las camas o bancos de almeja no se protegen con redes.
Técnicas de cosecha
En China, las almejas se cosechan tras 10-16 meses de engorda al alcanzar los 30 mm o mayores. En aguas europeas y en Norteamérica, las almejas generalmente se cosechan tras un período de 16 a 30 meses de cría y de mayor talla de la concha (30-40 mm) para obtener un mejor precio de venta. En ambos casos, generalmente se recogen rastrillándolas o se cosechan mecánicamente. En Europa, la cosecha manual de almeja japonesa consiste en rastrillarlas para desenterrarlas del sustrato y llevarlas a la superficie. La cosecha mecánica se realiza mediante succión o con dragas-elevadores; un tractor equipado con banda transportadora lateral puede excavar y clasificar las almejas en fondos arenosos, cubriendo más de 200 m²/hr (>600 kg/hr).
Manipulación y procesamiento
Una vez cosechadas, las almejas se colocan en cajas o bolsas y se transportan para ser seleccionadas mecánicamente. Entonces se almacenan en húmedo para purgar grava y arena, previo a su procesamiento y comercialización. Pueden almacenarse en agua por más tiempo en las áreas intermareales, utilizando bolsas de malla de plástico, o en estanques o bien suspendidas de balsas de almacenamiento, hasta su venta.
Costos de producción
Los costos de producción varían mucho, debido a diversos factores. Dependiendo de las características del sitio, las almejas pueden tardar entre 2 y 4 años para alcanzar una talla de mercado, lo que afecta el rendimiento general. La capacidad de carga local, la suavidad del suelo y los costos de los procedimientos operativos, tales como la preparación de parcelas de siembra, eliminación de depredadores, limpieza para evitar que las estructuras se atasquen en el lodo o por algas y la selección regular, son entre otros, los principales factores que afectan los costos totales de producción. Además, la selección de la técnica de cultivo influye de manera directa en los costos de producción. La talla de la semilla, cuando se adquiere de una incubadora, es otro aspecto fundamental. Los costos menores al adquirir semilla pequeña, pueden verse contrarrestados por una mayor tasa de mortalidad y mayores costos de operación (estructuras para cría de semilla); en contraste, la adquisición de semilla más grande es más cara por lo que se requieren mejores tasas de supervivencia para lograr un balance costo-beneficio. Las características del sustrato (arenoso versus fangoso) influyen en el proceso de cosecha y su eficiencia; por ejemplo, la cosecha mecánica es más fácil en fondos arenosos, mejorando el rendimiento. Todos estos factores deberán considerarse cuidadosamente en la planeación del cultivo de almeja, a fin de optimizar los costos de producción y seleccionar la estrategia de cultivo apropiada.
Enfermedades y medidas de control
| ENFERMEDAD | AGENTE | TIPO | SÍNDROME | MEDIDAS |
| Viral | Virus tipo herpes | Virus | Altas mortalidades esporádicas en incubadoras | No existen medidas curativas. Prevención y selección del sitio; monitorio de la transferencia de almejas. |
| Rickettsial | Rickettsiosis | Microcolonias intracitoplásmicas | Las microcolonias se forman en las células epiteliales de las bránquias y glándulas digestivas; infecciones leves y no asociadas a enfermedades; no hay efectos macroscópicos | No hay medidas curativas. Prevención y selección de sitio. |
| Bacterial (calcificación anormal; anillo café) | Vibrio tapetis | Bacteria | Enanismo; depósito de coloración café en la orilla del manto causado por material orgánico (conchiolina) | No existen medidas curativas. Prevención y selección del sitio; monitorio de la transferencia de almejas. |
| Parásito protozoario | Organismos tipo Perkinsus y Perkinsus atlanticus | Parásito protozoario | Nódulos o quistes blanquecinos o grisáceos sobre la superficie del manto y tejidos branquiales debido a una respuesta hemolítica; reducido esfuerzo reproductivo | No existen medidas curativas. Prevención y selección del sitio; monitorio de la transferencia de almejas. |
| Parásitos invertebrados | Cercaria elegans y Cercaria tapidis | Parásito Cercaria | Glándula genital infestada, algunas invaden el órgano digestivo y áreas circundantes; la glándula genital es la más seriamente afectada; impacto negativo en la reproducción y el crecimiento | No existen medidas curativas. Prevención y selección del sitio; monitorio de la transferencia de almejas. |
| – | Proctoeces orientalis | Tremátodo Felostómido | Alojado en los riñones de la almeja | No existen medidas curativas. Prevención y selección del sitio; monitorio de la transferencia de almejas. |
Expertos en patología
Se puede obtener asistencia a través de los siguientes recursos:
- European Shellfish Zoosanitary Reference Laboratory, IFREMER La Tremblade, BP 133, 17390 La Tremblade, France.
- University of Western Brittany (UBO), LEMAR Laboratory, IUEM Technopole Brest Iroise, 29280 Plouzane, France.
- Faculty of Applied Marine Science, Cheju National University, 1 Ara 1 Dong, Jeju City, Jeju Do 690-756, Republic of Korea.
- Instituto de Investigaciones Marinas Consejo Sup. de Invest. Cie., Eduardo Capelo 6, 36208 Vigo, Spain.
- Department of Fisheries & Oceans, Pacific Biological Station, Nanaimo, BC, Canada V9R 5K6.
- CEFAS, Weymouth Laboratory, Barrack Road, The Nothe, Weymouth Dorset, DT4 8UB, UK.
ESTADÍSTICAS
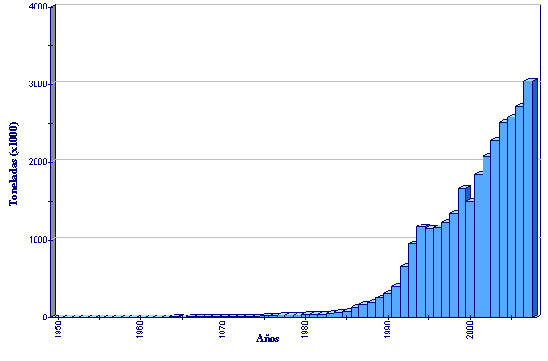
Estadísticas de producción
Producción de acuicultura global de Ruditapes philippinarum
(FAO Estadísticas pesqueras)
(FAO Estadísticas pesqueras)
Mercado y comercio
En China, la almeja japonesa es uno de los mariscos más comunes de aguas costeras. La mayoría de la almeja se vende viva en mercados locales a un precio promedio de 0,5 USD/kg. Generalmente se les fríe o prepara en sopa. La almeja también se comercializa en distintas presentaciones: congelada utilizando almeja depurada, empacada al vacío y congelada en bolsa de plástico lista para el horno microondas. Esta especie también se exporta a Japón. En Francia y el Reino Unido, toda la almeja cultivada se vende fresca para mercados locales y restaurantes. En Italia, la almeja se vende en el mercado doméstico pero también se exportan grandes cantidades a España. En Irlanda, la baja demanda obliga a los productores a exportar su producto fresco a Francia y España. Dado que la oferta de almeja capturada en aguas europeas ha crecido, el precio de la almeja japonesa ha bajado de 10 a 8,5 USD/kg, y después a 5 USD/kg en 1983, 1987 y en los años 90, respectivamente.
ESTATUS Y TENDENCIAS
Actualmente, todas las prácticas de cultivo de la almeja japonesa (almeja de Manila) se encuentran bajo control, incluyendo la producción en incubadoras; la especie es cultivada en gran parte del mundo. Las características biológicas de la especie favorecen su desarrollo. Por lo tanto la producción acuícola de Ruditapes philippinarum es probable que se incremente en el futuro próximo, sea por expansión de la superficie o por nuevas introducciones a áreas y países apropiados. Sin embargo, el principal factor que ha causado cambios en la producción en varios países ha sido el impacto de diversas enfermedades. Se considera que el microorganismo semejante al Perkinsus ha sido el responsable del declive de la producción de almeja japonesa en la República de Corea, generando mortalidades masivas anuales a finales de cada verano desde los años 90s, así como en Japón y China (en el mar Amarillo). Además, la enfermedad bacteriana del “anillo café” ha retardado la producción en varios países productores tradicionales (aguas Atlánticas Europeas). Además de estos problemas de patología, el desarrollo de poblaciones silvestres, tras la introducción de esta especie ha inducido cambios en las tendencias de producción, sea al facilitar la oferta de semilla (Italia) o en contraste, al competir económicamente con los cultivos (Francia), favoreciendo en consecuencia la pesca pública de captura. A lo largo de la costa oeste de Estados Unidos, los depredadores no autóctonos (cangrejo verde) constituyen un riesgo potencial para la producción comercial.
PRINCIPALES ASUNTOS
La incidencia de perkinsosis en la República de Corea, Japón y China, puede constituir la principal amenaza al cultivo de esta especie, tal como lo demuestra el actual declive de la producción en Corea y las mortalidades anormales en las aguas del sur de Europa. La futura producción dependerá de la manera en que se implementen las medidas zoosanitarias para limitar la expansión de esta enfermedad. A lo largo de la costa occidental de Norteamérica, los depredadores no autóctonos representan un riesgo potencial para la producción comercial.
Considerada como una especie exótica y mostrando un patrón en expansión en diversos países, la almeja japonesa puede representar una amenaza a la biodiversidad local. Se ha reportado hibridación natural entre la especie nativa europea Ruditapes decussatus y la exótica R. philippinarum. De manera similar al caso de otras especies de bivalvos filtradores, la magnitud y escala del impacto de diversas biotoxinas y la inhabilidad para controlar las toxinas de algas, constituyen un factor limitante para su cultivo. La acumulación de biotoxinas puede llegar a causar el cierre de industrias y la prohibición de ventas, y por lo tanto impactar la economía de las granjas de cultivo de la almeja.
La almeja Ruditapes philippinarum recientemente se ha constituido como una especie candidata al policultivo. Esta almeja se han cultivado conjuntamente con camarón marino [Marsupenaeus (Penaeus) japonicus y Fenneropenaeus (Penaeus) penicillatus]; con tilapia roja (Oreochromis mossambicus*O. niloticus) en estanques de agua de mar bajo fertilización; combinada con camarón (M. japonicus) y lubina (Dicentrarchus labrax) o con dorada (Sparus aurata); así como en los drenes de los estanques de camarón. R. philippinarum se ha cultivado alternándola con el cultivo de Porphyra. El policultivo ha mostrado su viabilidad y es una forma de limitar los impactos
Considerada como una especie exótica y mostrando un patrón en expansión en diversos países, la almeja japonesa puede representar una amenaza a la biodiversidad local. Se ha reportado hibridación natural entre la especie nativa europea Ruditapes decussatus y la exótica R. philippinarum. De manera similar al caso de otras especies de bivalvos filtradores, la magnitud y escala del impacto de diversas biotoxinas y la inhabilidad para controlar las toxinas de algas, constituyen un factor limitante para su cultivo. La acumulación de biotoxinas puede llegar a causar el cierre de industrias y la prohibición de ventas, y por lo tanto impactar la economía de las granjas de cultivo de la almeja.
La almeja Ruditapes philippinarum recientemente se ha constituido como una especie candidata al policultivo. Esta almeja se han cultivado conjuntamente con camarón marino [Marsupenaeus (Penaeus) japonicus y Fenneropenaeus (Penaeus) penicillatus]; con tilapia roja (Oreochromis mossambicus*O. niloticus) en estanques de agua de mar bajo fertilización; combinada con camarón (M. japonicus) y lubina (Dicentrarchus labrax) o con dorada (Sparus aurata); así como en los drenes de los estanques de camarón. R. philippinarum se ha cultivado alternándola con el cultivo de Porphyra. El policultivo ha mostrado su viabilidad y es una forma de limitar los impactos
Prácticas de acuicultura responsable
Los sucesos epizooticos en el cultivo de moluscos ha demostrado la necesidad de adoptar medidas preventivas para evitar la diseminación de enfermedades, incluyendo:
Código de Sanidad de Animales Acuáticos. Desde que se registró el Perkinsus atlanticus, toda transferencia de almeja debe llevarse a cabo con gran cuidado. Aún cuando no se ha registrado el Vibrio tapetis, también existe una gran preocupación por lo que se recomienda su monitoreo.
Son de particular importancia para esta especie: la implementación del Código de Conducta para la Pesca Responsable de la FAO (Artículo 9 – Desarrollo de la Acuicultura), el Código ICES de Prácticas para la Introducción y Transferencia de Organismos Marinos y las Recomendaciones para una Acuicultura Sustentable de la Convención para la Diversidad Biológica.
La almeja japonesa ha colonizado, no intencionalmente, áreas costeras de varios países en donde se ha desarrollado el cultivo de la almeja. Por lo tanto, puede considerarse como una plaga en algunas condiciones ambientales específicas.
- Monitoreo de la salud de las poblaciones de almeja.
- Establecimiento de sistemas de zonificación para limitar la diseminación de parásitos.
- Uso apropiado de prácticas de manejo cuando se transfieran o introduzcan especies acuícolas.
Código de Sanidad de Animales Acuáticos. Desde que se registró el Perkinsus atlanticus, toda transferencia de almeja debe llevarse a cabo con gran cuidado. Aún cuando no se ha registrado el Vibrio tapetis, también existe una gran preocupación por lo que se recomienda su monitoreo.
Son de particular importancia para esta especie: la implementación del Código de Conducta para la Pesca Responsable de la FAO (Artículo 9 – Desarrollo de la Acuicultura), el Código ICES de Prácticas para la Introducción y Transferencia de Organismos Marinos y las Recomendaciones para una Acuicultura Sustentable de la Convención para la Diversidad Biológica.
La almeja japonesa ha colonizado, no intencionalmente, áreas costeras de varios países en donde se ha desarrollado el cultivo de la almeja. Por lo tanto, puede considerarse como una plaga en algunas condiciones ambientales específicas.
REFERENCIAS
Bibliograf�a
| Barnabe, G. (ed.). 1994. Aquaculture: biology and ecology of cultured species. Ellis Horwood Series in Aquaculture and Fisheries Support, Wiley & Sons, Chichester, UK. 403 pp. |
| Bartley, D.M. 1994. Towards increased implementation of the ICES [International Council for the Exploration of the Sea]/EIFAC [European Inland Fisheries Advisory Commission] codes of practice and manual of procedures for consideration of introduction and transfers of marine and freshwater organisms. 18th Session European Inland Fisheries Advisory Commission (EIFAC), Rome, Italy, 17-25 May. Document N° EIFAC/XVIII/94/inf. 18. FAO, Rome, Italy. 3 pp. |
| Carlton, J.T. 1999. Molluscan invasions in marine and estuarine communities. Malacologia, 41(2):439-454. |
| Choi, K.S., Park, K.I., Lee, K.W. & Matsuoka, K. 2002. Infection intensity, prevalence, and histopathology of Perkinsus sp. in the Manila clam, Ruditapes philippinarum in Isahaya Bay, Japan. Journal of Shellfish Research, 21(1):119-125. |
| ESAV. 1990. Tapes philippinarum: biologia e sperimentazione. Coord. G. Alessandra. Regione Veneto Ente di Sviluppo Agricolo, Regione Veneto, Italy. 299 pp. |
| Gosling, E.M. 2003. Bivalve molluscs: biology, ecology and culture. Fishing New Books, Oxford, England. 443 pp. |
| Goulletquer, P. 1997. A bibliography of the Manila clam Tapes philippinarum. IFREMER, RIDRV-97.02/RA/LA. IFREMER, Tremblade, France.122 pp. |
| Guo, X., Ford, S. & Zhang, F. 1999. Molluscan aquaculture in China. Journal of Shellfish Research, 18(1):19-31. |
| ICES. 1995. Code of practice on the introductions and transfers of marine organisms. ICES Copenhagen, Denmark. 5 pp. |
| ICES. 2004. Trends in important diseases affecting the culture of fish and molluscs in the ICES area, 1998-2002. Cooperative Research Report, No 265, ICES, Copenhagen, Denmark. 33 pp. |
| IFREMER. 1988. Dossier: La Palourde, dossier d'élevage [Clam culture: a guide]. Ifremer edit., Paris, France. 106 pp. |
| MacKenzie, C.L. Jr., Burnell, V.G. Jr., Rosenfield, A. & Hobart, W.L. (eds.). 1997. The history, present condition, and future of molluscan fisheries of North and Central America and Europe. US Dept of Commerce, NOAA Technical Reports 127(1):234 pp; 128(2):217 pp; 129(3):240 pp. NMFS, Washington DC, USA. |
| Manzi, J.J. & Castagna, M. (eds.). Clam mariculture in North America. Developments in Aquaculture and Fisheries Science, 19. Elsevier Press, Amsterdam, Netherlands. 461 pp. |
| Menzel, W. (ed.). 1990. Estuarine and Marine Bivalve Mollusk Culture. CRC Press, Boca Raton, Florida, USA. 362 pp. |
| Turner, G.E. (ed.). 1988. Codes of practice and manual of procedures for consideration of introductions and transfers of marine and freshwater organisms. EIFAC Occasional Paper No. 23. European Inland Fisheries Advisory Commission (EIFAC), FAO, Rome, Italy, 46 pp. |
