IDENTIDAD
Rasgos biológicos
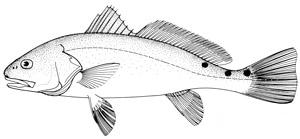
Cuerpo alargado, con lomo ligeramente arqueado y cabeza en declive. Coloración café cobrizo o rojizo, pero con el vientre blanquizco. Hocico chato con boca grande inferior, conteniendo bandas de dientes viliformes. Sin barbillas, que distingue a esta especie de la cercana corvina (Pogonias cromis). Dos aletas dorsales, la primera con diez espinas rígidas y la segunda con una espina rígida y múltiples rayos blandos (24). Aleta caudal ligeramente cóncava con uno o más cromatóforos negros sobre línea lateral. Durante la temporada de desove, los machos producen el característico tamborileo nasal al frotar músculos especializados contra la vejiga natatoria.
Galería de imágenes
 |
 |
Pies de cría de Corvinón ocelado |
Juvenil de Corvinón ocelado |
PERFIL
Antecedentes históricos
El interés en el cultivo de corvinón ocelado en cautiverio empezó a finales de la década de 1970, motivado por la preocupación de la disminución de las poblaciones silvestres debido a las actividades de pesca comercial y recreativa. A partir de entonces se implementó una gama de medidas regulatorias (ejemplo: límites de talla y cantidad), habiéndose prohibido por completo la pesca comercial en muchas áreas. Las prácticas de acuicultura se iniciaron en Estados Unidos de América, particularmente en Texas y Florida, a fin de aportar alternativas a la pesca silvestre y para permitir la recuperación de las poblaciones. Con el desarrollo de técnicas de cultivo confiables, la producción comercial de esta especial se ha expandido a otros países ya que el Corvinón ocelado es una especie ampliamente apreciada como alimento, es relativamente resistente y se adapta bien a las condiciones de cautiverio.
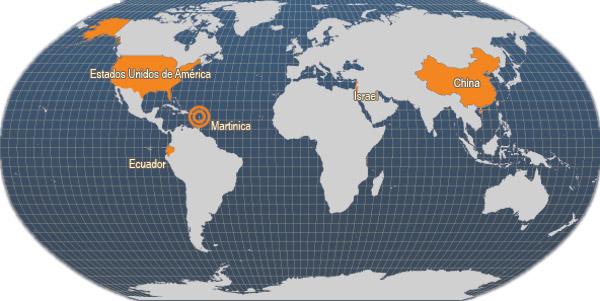
Principales países productores

Principales países productores de Sciaenops ocellatus (FAO Estadísticas pesqueras, 2006)
Hábitat y biología
El corvinón ocelado es un pez euralino que se distribuye a lo largo de las costas del Océano Atlántico y del Golfo de México desde Cabo Cod, Massachusetts hasta Tuxpan, México. Los adultos desovan de agosto a octubre en aguas costeras, frecuentemente cerca de los recodos de marea. El corvinón ocelado libera huevos pelágicos (de aproximadamente 1,0 mm de diámetro), las hembras grandes producen >1 millón de huevos. Las corrientes transportan a las larvas de aproximadamente 6-8 mm (longitud estándar) hasta los estuarios, depositándolas en las praderas marinas. Los juveniles y sub-adultos generalmente permanecen en las bahías y estuarios, alejándose de la costa a los 3,5 a 5 años de edad para reunirse con la población adulta reproductiva.
PRODUCCIÓN
Pies de cría
En algunos casos, los huevos o larvas se adquieren en incubadoras, como una alternativa al mantenimiento y reproducción de los pies de cría. Sin embargo el corvinón ocelado se adapta bien al cautiverio y muchos productores conservan sus pies de cría para garantizar un abasto constante de larvas para la fase de crecimiento. A los adultos se les puede mantener en tanques de fibra de vidrio circulares (de 10 a 17 m3, y 1,5 m de altura) mismos que se conectan a un filtro externo. Se pueden reproducir de 4 a 6 peces en estos sistemas, utilizando una proporción de sexos de 1:1. Generalmente a los pies de cría se les alimenta de 3 a 5 veces por semana con una dieta a base de peces, calamar, camarón y/o alimentos peletizados.
La mayoría de los países que producen corvinón ocelado deben importar los pies de cría, por no ser una especie endémica. Como resultado, es factible que se produzca un deterioro endémico tras varios años de cultivo a partir de un número limitado de pies de cría, lo que puede afectar negativamente a la producción. Con el fin de preservar la diversidad genética de los cultivos de corvinón ocelado, deberán mantenerse un número apropiado de individuos y familias para minimizar estos efectos de entrecruza.
Desove
Se han desarrollado técnicas adecuadas para lograr el desove de esta especie durante todo el año. Puede utilizarse un régimen de fotoperíodo y temperadura de 120 días para lograr el desove del cortinón ocelado en cautiverio. Inicialmente se logra que los pies de cría se aclimaten a temperaturas de 17 °C con fotoperíodos de 9 horas de luz (HL) que simulan las condiciones de invierno para la presencia de los adultos en el medio silvestre. Tras la adaptación de los adultos, gradualmente se incrementa la temperatura y el fotoperíodo para posteriormente disminuirlos a lo largo de un período de 120 días.
Tras el acondicionamiento inicial de los pies de cría, se puede lograr el desove controlado durante todo el año mediante la manipulación de la temperatura. Por ejemplo, el desove puede suspenderse temporalmente cuando la temperatura baja de los 23 °C y provocarla nuevamente cuando se eleva la temperatura a más de 23 °C. El corvinón ocelado generalmente desova inmediatamente después de que se apagan las luces al atardecer. Los huevos son boyantes o de flotación positiva en salinidades mayores a 25‰. Durante la noche, los huevos se transportan a un filtro externo, en donde se recolectan en un bolsa de nitex de malla de aproximadamente 500 micras.
Tras la remoción de los huevos del colector, éstos se colocan directamente en tanques de cría o inicialmente se pasan a incubadoras (500-2 000 litros; 200-500 huevos/l) y posteriormente se transfieren a tanques de crecimiento. La desinfección de los huevos con formalina en 50-100 ppm durante aproximadamente una hora, ayuda a disminuir la carga bacteriana y el crecimiento de hongos. Los huevos son de aproximadamente 1 mm de diámetro y eclosionan en un período de 18-25 horas, a temperaturas de entre 24 y 28 °C.
Los sistemas para cría típicamente constan de tanques circulares de fibra de vidrio ubicados en naves con condiciones ambientales controladas, en volúmenes promedio de 5 000 a 15 000 litros, pero al iniciar su alimentación, las larva suelen ser transferidas a estanques exteriores para proseguir su cultivo. La densidad de cría varía de 10 a 30 larvas/litro y la supervivencia en la etapa larvaria puede ser superior al 50 por ciento. Inicialmente, la temperatura y salinidad óptima para la incubación y cría de larvas varía entre 25-30 °C y 25-30‰, aunque también pueden emplearse rangos mayores para larvas de mayor edad. Por ejemplo, se han reportado elevadas tasas de sobrevivencia a salinidades de 10‰, 5‰ y 1‰ para las larvas de 3 mm, 6 mm y 15 mm respectivamente. Las larvas pueden criarse hasta una talla apropiada para la fase de crecimiento tanto en incubadoras como en estanques.
Cría intensiva de larvas
Las larvas de corvinón ocelado miden aproximadamente 2,2 mm (Longitud Estándar) al eclosionar y se les puede comenzar a alimentar a los tres días. A las larvas se le alimenta inicialmente con rotíferos en concentraciones de 5-10/ml durante los 3-10 días de edad y posteriormente con nauplios de Artemia entre los días 11-15. A partir de este momento las larvas se alimentarán con una dieta micro-particulada, si bien su alimentación es mejor combinando presas vivas y dieta inerte durante el período de destete. Alternativamente, el corvinón ocelado puede alimentarse con una combinación de rotíferos y dieta inerte (~0,25 mm) durante los días 3 a7, seguida de dieta inerte exclusivamente –incrementando gradualmente el tamaño de las partículas- sin sacrificar la tasa de crecimiento y superviviencia. Las presas vivas, frecuentemente se enriquecen con ácidos grasos altamente insaturados, tales como ácido araquidónico (ARA), acido eicopentanoico (EPA) y ácido decosahexanoico (DHA), que incrementan el crecimiento y la supervivencia. Se emplea con frecuencia el enriquecimiento para mejorar la composición de ácidos grasos de los alimentos vivos a base de microalgas y pasta de micro-algas, preparaciones comerciales y aceites de pescado. Al agregar microalgas a los tanques de cría (Nannochloris occulata, Isochrysis galbana) en concentraciones de 40 000 – 100 000 células/ml también incrementa el crecimiento larvario y la supervivencia. Una vez que los peces alcanzan la etapa juvenil (menos de 1 mes), pueden trasladarse a estanques o jaulas de redes para su crecimiento.
Los estanques de dimensiones de 0,2 a 1,0 ha, generalmente se llenan entre 5 y 10 días previos a la siembra de peces. Se agregan fertilizantes orgánicos e inorgánicos a fin de propiciar la reproducción del fitoplancton que a su vez genera las comunidades de zooplancton, inicialmente consistentes en copépodos. Las larvas (de 2 días de vida; 740 000/ha) se trasladan de las incubadoras a los estanques una vez que los niveles de zooplankton alcanzan una densidad de aproximadamente 250 organismos/l. Los peces se mantienen en estos sistemas hasta los 30 días de vida (~30 mm SL) y posteriormente se trasladan a estanques mayores o jaulas de redes.
El corvinón ocelado se cría en jaulas o en estanques:
Cultivo en estanques
A finales de la década de 1980 y principios de los años 90s el cultivo en estanques de corvinón ocelado en Estados Unidos de América se vio severamente afectada por las bajas temperaturas en los meses de invierno, provocando una alta mortalidad. La temperatura letal para los juveniles de corvinón ocelado es de entre 8 y 10 °C, aunque depende también de la salinidad y la tasa de descenso de la temperatura. A fin de combatir las pérdidas debidas a las bajas temperaturas, los acuicultores han modificado las prácticas de producción. Por ejemplo, los peces se trasladan a sitios interiores cuando tienen un peso aproximado de 1 g, manteniéndolos en sistemas semi-cerrados con recirculación. Posteriormente son regresados a estanques exteriores cuando ya ha aumentado la temperatura y han alcanzado un peso de entre 150 y 225 g. Los alevines son relativamente caníbales, por lo que la oportuna selección de tallas durante el tiempo que se mantienen en sitios interiores ayuda a disminuir las tasas de mortalidad, y por tanto contribuye a incrementar la producción general. Las tallas comerciales de los peces producidos bajo este sistema (~1 kg) pueden alcanzarse en 11 meses.
Cultivo en jaulas
Para el cultivo se utiliza una amplia gama y dimensiones de jaulas para peces marinos. En China, las jaulas se construyen con bolsas de maya flexible, adheridas a marcos rígidos, generalmente de entre 1,5-2,5 m3. Los alevines de corvinón ocelado (0,2 g) se estabulan en densidades de 1 000 crías/m3. Al crecer los peces, pueden trasladarse a jaulas mayores disminuyendo su densidad hasta ~400 crías/m3. El canibalismo es un problema frecuente, por lo que los peces se seleccionan por talla regularmente para disminuir la mortalidad. La talla comercial (~1 kg) normalmente se alcanza en un plazo de un año.
Los alevines de corvinón ocelado crecen bien con una gama de alimentos comerciales formulados específicamente para esta y otras especies marinas de aguas templadas. Los requerimientos nutricionales están bien identificados. Los juveniles de corvinón ocelado requieren una dieta que contenga entre 35 y 45 por ciento de proteína para el máximizar su crecimiento. La proteína de su dieta proviene inicialmente de pescado, aunque puede sustituirse por soya siempre que se mantenga un mínimo de 10 por ciento de proteína de origen animal. Como se indicó más arriba, para las larvas y juveniles la dieta requiere ácidos grasos altamente insaturados HUFAs; se recomienda incluir n-3 HUFAs con ~10 por ciento de lípidos. Se dispone de poca información relativa a los requerimientos de vitaminas y minerales por parte de esta especie; estos ingredientes generalmente se adicioan a la dieta por medio de mezclas comerciales que se han desarrollado para la acuicultura de otras especies. Las dietas comercialess para el cultivo de corvinón ocelado, generalmente contienen un 40 por ciento de proteína cruda, 5 a 7 por ciento de aceite de pescado, <7 por ciento de fibra cruda, junto con pre-mezclas de vitaminas y minerales.
El corvinón ocelado puede cosecharse de los estanque mediante una red de cerco. A partir de un estanque pueden generarse múltiples cosechas utilizando una red seleccionadora que permite capturar peces de cierta talla, con lo que se llega a obtener una mayor producción. Alternativamente, los estanques pueden drenarse y recolectar los peces en un contenedor, en el cual se capturan con mayor facilidad. En jaulas, el corvinón ocelado puede cosecharse mediante el uso de redes cuchara tras concentrar a los peces al levantar levemente el fondo de la red o alternativamente sacando totalmente la red del agua.
Para mantener el valor nutricional y estético de los peces y evitar la contaminación, el corvinón ocelado requiere un manejo cuidadoso en todas las etapas de cultivo, así como durante la cosecha y procesamiento. Todo el equipo empleado en el manejo o proceso de los peces debe mantenerse adecuadamente y completamente limpio antes, durante y tras su uso en el procesamiento. Se debe contactar a las autoridades locales responsables de la supervisión del manejo y procesamiento de los alimentos marinos para disponer de información detallada relativa a los procedimientos sanitarios aplicables.
Con base en los registros de 1994, se realiza el siguiente análisis de los costos de producción asociados a la operación de las actividades acuícolas del corvinón ocelado en Estados Unidos de América, empleando estanques para el crecimiento de alevines desde los 0,4 g hasta 1 kg, en un período aproximado de un año. Si bien las estimaciones de costos registradas pierden validez debido a inflación, etc., los factores utilizados para estimar los costos de producción resultan ser relevantes.
´┐Ż
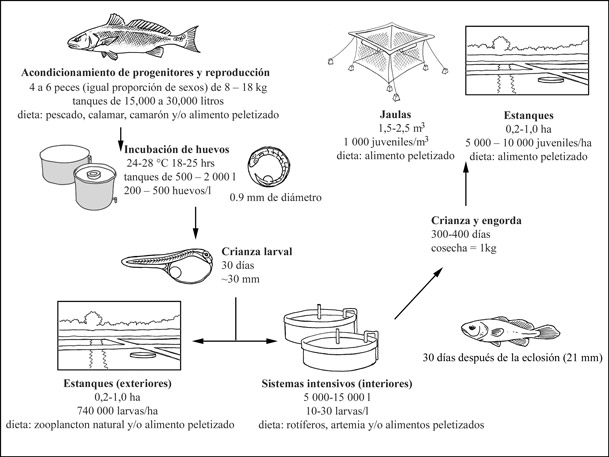
Ciclo de producción

Ciclo de producción de Sciaenops ocellatus
Sistemas de producción
Suministro de semilla
Pies de cría
En algunos casos, los huevos o larvas se adquieren en incubadoras, como una alternativa al mantenimiento y reproducción de los pies de cría. Sin embargo el corvinón ocelado se adapta bien al cautiverio y muchos productores conservan sus pies de cría para garantizar un abasto constante de larvas para la fase de crecimiento. A los adultos se les puede mantener en tanques de fibra de vidrio circulares (de 10 a 17 m3, y 1,5 m de altura) mismos que se conectan a un filtro externo. Se pueden reproducir de 4 a 6 peces en estos sistemas, utilizando una proporción de sexos de 1:1. Generalmente a los pies de cría se les alimenta de 3 a 5 veces por semana con una dieta a base de peces, calamar, camarón y/o alimentos peletizados.
La mayoría de los países que producen corvinón ocelado deben importar los pies de cría, por no ser una especie endémica. Como resultado, es factible que se produzca un deterioro endémico tras varios años de cultivo a partir de un número limitado de pies de cría, lo que puede afectar negativamente a la producción. Con el fin de preservar la diversidad genética de los cultivos de corvinón ocelado, deberán mantenerse un número apropiado de individuos y familias para minimizar estos efectos de entrecruza.
Desove
Se han desarrollado técnicas adecuadas para lograr el desove de esta especie durante todo el año. Puede utilizarse un régimen de fotoperíodo y temperadura de 120 días para lograr el desove del cortinón ocelado en cautiverio. Inicialmente se logra que los pies de cría se aclimaten a temperaturas de 17 °C con fotoperíodos de 9 horas de luz (HL) que simulan las condiciones de invierno para la presencia de los adultos en el medio silvestre. Tras la adaptación de los adultos, gradualmente se incrementa la temperatura y el fotoperíodo para posteriormente disminuirlos a lo largo de un período de 120 días.
Tras el acondicionamiento inicial de los pies de cría, se puede lograr el desove controlado durante todo el año mediante la manipulación de la temperatura. Por ejemplo, el desove puede suspenderse temporalmente cuando la temperatura baja de los 23 °C y provocarla nuevamente cuando se eleva la temperatura a más de 23 °C. El corvinón ocelado generalmente desova inmediatamente después de que se apagan las luces al atardecer. Los huevos son boyantes o de flotación positiva en salinidades mayores a 25‰. Durante la noche, los huevos se transportan a un filtro externo, en donde se recolectan en un bolsa de nitex de malla de aproximadamente 500 micras.
Tras la remoción de los huevos del colector, éstos se colocan directamente en tanques de cría o inicialmente se pasan a incubadoras (500-2 000 litros; 200-500 huevos/l) y posteriormente se transfieren a tanques de crecimiento. La desinfección de los huevos con formalina en 50-100 ppm durante aproximadamente una hora, ayuda a disminuir la carga bacteriana y el crecimiento de hongos. Los huevos son de aproximadamente 1 mm de diámetro y eclosionan en un período de 18-25 horas, a temperaturas de entre 24 y 28 °C.
Producción en viveros
Los sistemas para cría típicamente constan de tanques circulares de fibra de vidrio ubicados en naves con condiciones ambientales controladas, en volúmenes promedio de 5 000 a 15 000 litros, pero al iniciar su alimentación, las larva suelen ser transferidas a estanques exteriores para proseguir su cultivo. La densidad de cría varía de 10 a 30 larvas/litro y la supervivencia en la etapa larvaria puede ser superior al 50 por ciento. Inicialmente, la temperatura y salinidad óptima para la incubación y cría de larvas varía entre 25-30 °C y 25-30‰, aunque también pueden emplearse rangos mayores para larvas de mayor edad. Por ejemplo, se han reportado elevadas tasas de sobrevivencia a salinidades de 10‰, 5‰ y 1‰ para las larvas de 3 mm, 6 mm y 15 mm respectivamente. Las larvas pueden criarse hasta una talla apropiada para la fase de crecimiento tanto en incubadoras como en estanques.
Cría intensiva de larvas
Las larvas de corvinón ocelado miden aproximadamente 2,2 mm (Longitud Estándar) al eclosionar y se les puede comenzar a alimentar a los tres días. A las larvas se le alimenta inicialmente con rotíferos en concentraciones de 5-10/ml durante los 3-10 días de edad y posteriormente con nauplios de Artemia entre los días 11-15. A partir de este momento las larvas se alimentarán con una dieta micro-particulada, si bien su alimentación es mejor combinando presas vivas y dieta inerte durante el período de destete. Alternativamente, el corvinón ocelado puede alimentarse con una combinación de rotíferos y dieta inerte (~0,25 mm) durante los días 3 a7, seguida de dieta inerte exclusivamente –incrementando gradualmente el tamaño de las partículas- sin sacrificar la tasa de crecimiento y superviviencia. Las presas vivas, frecuentemente se enriquecen con ácidos grasos altamente insaturados, tales como ácido araquidónico (ARA), acido eicopentanoico (EPA) y ácido decosahexanoico (DHA), que incrementan el crecimiento y la supervivencia. Se emplea con frecuencia el enriquecimiento para mejorar la composición de ácidos grasos de los alimentos vivos a base de microalgas y pasta de micro-algas, preparaciones comerciales y aceites de pescado. Al agregar microalgas a los tanques de cría (Nannochloris occulata, Isochrysis galbana) en concentraciones de 40 000 – 100 000 células/ml también incrementa el crecimiento larvario y la supervivencia. Una vez que los peces alcanzan la etapa juvenil (menos de 1 mes), pueden trasladarse a estanques o jaulas de redes para su crecimiento.
Criadero
Los estanques de dimensiones de 0,2 a 1,0 ha, generalmente se llenan entre 5 y 10 días previos a la siembra de peces. Se agregan fertilizantes orgánicos e inorgánicos a fin de propiciar la reproducción del fitoplancton que a su vez genera las comunidades de zooplancton, inicialmente consistentes en copépodos. Las larvas (de 2 días de vida; 740 000/ha) se trasladan de las incubadoras a los estanques una vez que los niveles de zooplankton alcanzan una densidad de aproximadamente 250 organismos/l. Los peces se mantienen en estos sistemas hasta los 30 días de vida (~30 mm SL) y posteriormente se trasladan a estanques mayores o jaulas de redes.
Técnicas de engorda
El corvinón ocelado se cría en jaulas o en estanques:
Cultivo en estanques
A finales de la década de 1980 y principios de los años 90s el cultivo en estanques de corvinón ocelado en Estados Unidos de América se vio severamente afectada por las bajas temperaturas en los meses de invierno, provocando una alta mortalidad. La temperatura letal para los juveniles de corvinón ocelado es de entre 8 y 10 °C, aunque depende también de la salinidad y la tasa de descenso de la temperatura. A fin de combatir las pérdidas debidas a las bajas temperaturas, los acuicultores han modificado las prácticas de producción. Por ejemplo, los peces se trasladan a sitios interiores cuando tienen un peso aproximado de 1 g, manteniéndolos en sistemas semi-cerrados con recirculación. Posteriormente son regresados a estanques exteriores cuando ya ha aumentado la temperatura y han alcanzado un peso de entre 150 y 225 g. Los alevines son relativamente caníbales, por lo que la oportuna selección de tallas durante el tiempo que se mantienen en sitios interiores ayuda a disminuir las tasas de mortalidad, y por tanto contribuye a incrementar la producción general. Las tallas comerciales de los peces producidos bajo este sistema (~1 kg) pueden alcanzarse en 11 meses.
Cultivo en jaulas
Para el cultivo se utiliza una amplia gama y dimensiones de jaulas para peces marinos. En China, las jaulas se construyen con bolsas de maya flexible, adheridas a marcos rígidos, generalmente de entre 1,5-2,5 m3. Los alevines de corvinón ocelado (0,2 g) se estabulan en densidades de 1 000 crías/m3. Al crecer los peces, pueden trasladarse a jaulas mayores disminuyendo su densidad hasta ~400 crías/m3. El canibalismo es un problema frecuente, por lo que los peces se seleccionan por talla regularmente para disminuir la mortalidad. La talla comercial (~1 kg) normalmente se alcanza en un plazo de un año.
Suministro de alimento
Los alevines de corvinón ocelado crecen bien con una gama de alimentos comerciales formulados específicamente para esta y otras especies marinas de aguas templadas. Los requerimientos nutricionales están bien identificados. Los juveniles de corvinón ocelado requieren una dieta que contenga entre 35 y 45 por ciento de proteína para el máximizar su crecimiento. La proteína de su dieta proviene inicialmente de pescado, aunque puede sustituirse por soya siempre que se mantenga un mínimo de 10 por ciento de proteína de origen animal. Como se indicó más arriba, para las larvas y juveniles la dieta requiere ácidos grasos altamente insaturados HUFAs; se recomienda incluir n-3 HUFAs con ~10 por ciento de lípidos. Se dispone de poca información relativa a los requerimientos de vitaminas y minerales por parte de esta especie; estos ingredientes generalmente se adicioan a la dieta por medio de mezclas comerciales que se han desarrollado para la acuicultura de otras especies. Las dietas comercialess para el cultivo de corvinón ocelado, generalmente contienen un 40 por ciento de proteína cruda, 5 a 7 por ciento de aceite de pescado, <7 por ciento de fibra cruda, junto con pre-mezclas de vitaminas y minerales.
Técnicas de cosecha
El corvinón ocelado puede cosecharse de los estanque mediante una red de cerco. A partir de un estanque pueden generarse múltiples cosechas utilizando una red seleccionadora que permite capturar peces de cierta talla, con lo que se llega a obtener una mayor producción. Alternativamente, los estanques pueden drenarse y recolectar los peces en un contenedor, en el cual se capturan con mayor facilidad. En jaulas, el corvinón ocelado puede cosecharse mediante el uso de redes cuchara tras concentrar a los peces al levantar levemente el fondo de la red o alternativamente sacando totalmente la red del agua.
Manipulación y procesamiento
Para mantener el valor nutricional y estético de los peces y evitar la contaminación, el corvinón ocelado requiere un manejo cuidadoso en todas las etapas de cultivo, así como durante la cosecha y procesamiento. Todo el equipo empleado en el manejo o proceso de los peces debe mantenerse adecuadamente y completamente limpio antes, durante y tras su uso en el procesamiento. Se debe contactar a las autoridades locales responsables de la supervisión del manejo y procesamiento de los alimentos marinos para disponer de información detallada relativa a los procedimientos sanitarios aplicables.
Costos de producción
Con base en los registros de 1994, se realiza el siguiente análisis de los costos de producción asociados a la operación de las actividades acuícolas del corvinón ocelado en Estados Unidos de América, empleando estanques para el crecimiento de alevines desde los 0,4 g hasta 1 kg, en un período aproximado de un año. Si bien las estimaciones de costos registradas pierden validez debido a inflación, etc., los factores utilizados para estimar los costos de producción resultan ser relevantes.
| Costos de operaciòn | Proporción de costos anuales (%) |
| Alimento | 55,5 |
| Costo de alevines para crecimiento | 19,3 |
| Fuerza de trabajo | 14,3 |
| Productos químicos (ejemplo: fertilizantes, tratamientos contra enfermedades) | 4,8 |
| Almacenamiento y comercialización | 3,4 |
| Mantenimiento y reparacón de equipos | 2,7 |
Enfermedades y medidas de control
La siguiente tabla contiene información relativa a las enfermedades que afectan al corvinón ocelado durante su cultivo. Los acuicultores deben familiarizarse con la normatividad local, en relación al empleo de productos químicos específicos y medicamentos aprobados para su uso en alimentos, así como las regulaciones locales de países importadores del producto.
En algunos casos se han empleado para el tratamiento de enfermedades antibióticos y otros productos farmacéuticos, pero su inclusión en la siguiente tabla no implica una recomendación de la FAO.
Expertos en patología
Generalmente las agencias gubernamentales, empresas privadas e instituciones educativas ofrecen servicios relacionados al diagnóstico y tratamiento de las enfermedades que afectan a los organismos acuáticos. Se puede obtener ayuda para localizar servicios de diagnóstico, mediante contacto con autoridades locales responsables de la producción de peces en cautiverio.
En algunos casos se han empleado para el tratamiento de enfermedades antibióticos y otros productos farmacéuticos, pero su inclusión en la siguiente tabla no implica una recomendación de la FAO.
| ENFERMEDAD | AGENTE | TIPO | SÍNDROME | MEDIDAS |
| Necrosis nerviosa viral | Nodavirus | Virus | Nado errático (en espiral y remolino,); necrosis neuronal; inflamación de vejiga natatoria; coloración obscurecida; pérdida de apetito | No se conoce tratamiento; desinfección de sistemas de cultivo entre camadas (tratamiento UV del agua de cultivo, ozonificación; clorinación de materiales); eliminación de peces enfermos |
| Enteromyxosis (myxidiosis) | Myxidium leei | Endoparáito mixosporidio | Esporas en mucosa de tracto digestivo; inflamación de tracto digestivo; decoloración; pérdida de escamas; úlceras en piel | No se conoce tratamiento; desinfección de sistemas de cultivo; eliminación de peces enfermos |
| Lymphocystis | Iridovirus | Virus | Piel, escamas y ocasionalmente branquias con fibroblastos dérmicos blancos o rojizos (similares a coliflores). | No se conoce tratamiento; desinfección de sistemas de cultivo; cuarentena de peces – ocasionalmente los peces se recuperan por sí mismos; minimizar densidades |
| Crustáceos ectoparásitos (pulga del pez) | Copépodos; isópodos; branchiuros | Parásitos externos | Pequeños crustáceos adheridos a branquias, boca y piel; úlceras en piel | Inmersión en agua dulce (5-15 min); inmersión en formalina (30 min, 2-4 ml formalina en 10 litros) – no aprobado para peces comestibles |
| Vibriosis (infección bacteriana sistémica) | Vibrio sp. | Bacteriana | Abdomen inflamado; úlceras en piel; hemorragias en cuerpo; ojos prominentes; letargo; lesiones internas | Suministro de antibacterianos por vía del agua o alimentos; remoción y tratamiento de peces enfermos; desinfección de sistemas de cultivo; reducción del estrés |
| Infección bacteriana sistémica | Streptococcus iniaei | Bacteriana | Úlceras en piel; septicemia; ojos prominentes; hemorragias en cuerpo; coloración oscurecida | Suministro de antibacterianos por vía del agua o alimentos; remoción y tratamiento de peces enfermos; desinfección de sistemas de cultivo; reducción de estrés |
| Amyloodiniosis (enfermedad de terciopelo marino) | Amyloodinium ocellatum | Dinoflagelados | Trophont (aparece como pequeñas manchas blancas) en la piel, aletas y/o branquias; debilidad; anorexia; comezón | Inmersión en agua fresca (5-15 min); drenado del tanque (al menos 6 volúmenes del tanque por día); filtración (microfiltro, tambor/filtro de cuentas); sulfato de cobre - no aprobado para peces comestibles; inmersión en formalina (30 min, 2-4 ml formalina en 10 litros) - no aprobado para peces comestibles |
| Cryptocaryonosis (enfermedad de mancha blanca/ich marino) | Cryptocaryon irritans | Parásito externo protozoario | Escarificación blanca de la piel; dificultad respiratoria; comezón; escamado de la piel; apetito reducido | Reducción de salinidad (≤16‰ por ~14 días, ≤10‰ por 3 horas); baja temperatura <19 °C; sulfato de cobre- no aprobado para peces comestibles; inmersión en formalina (30 min, 2-4 ml formalina en 10 litros) - no aprobado para peces comestibles |
Expertos en patología
Generalmente las agencias gubernamentales, empresas privadas e instituciones educativas ofrecen servicios relacionados al diagnóstico y tratamiento de las enfermedades que afectan a los organismos acuáticos. Se puede obtener ayuda para localizar servicios de diagnóstico, mediante contacto con autoridades locales responsables de la producción de peces en cautiverio.
ESTADÍSTICAS
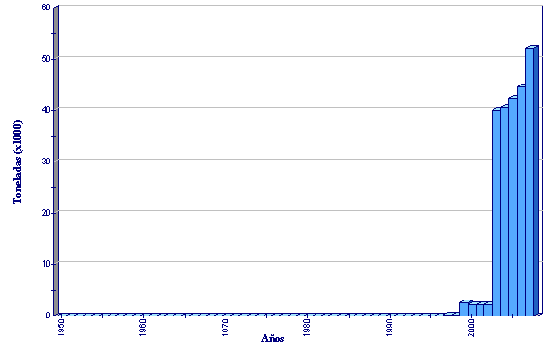
Estadísticas de producción
Producci´┐Żn de acuicultura global de Sciaenops ocellatus
(FAO Estadísticas pesqueras)
(FAO Estadísticas pesqueras)

Mercado y comercio
Los principales productos de la industria del corvinón ocelado son filetes frescos o congelados (170-340 g), aunque también se vende ocasionalmente como pescado entero eviscerado. Como ocurre con otras especies, los precios de mercado se rigen por los factores de la oferta y la demanda. Actualmente en Estados Unidos de América, el precio del corvinón ocelado, comprado en las granjas comerciales es de 4,19-4,63 USD/kg. No se dispone de información del comercio de esta especie en China.
ESTATUS Y TENDENCIAS
El corvinón ocelado es una especie resistente y de relativo rápido crecimiento, para la cual se han atendido muchas de las dificultades asociadas al cultivo de especies marinas, y en muchos casos se han superado (vgr. desove, nutrición y tolerancia ambiental). Sin embargo, la alta mortalidad debido a bajas temperaturas requiere mayor consideración en los sitios y/o sistemas de producción empleados por los acuicultores. Sin embargo, con el avance de las tecnologías acuícolas, es probable que la producción del corvinón ocelado continúe incrementándose en todo el mundo, al elevarse la eficiencia de las granjas existentes y la expansión a otros países. Más investigación en los rubros de eficiencia alimentaria, tratamiento de enfermedades, tolerancia a las temperaturas y sistemas acuícolas de recirculación, contribuirán a garantizar una producción sólida en términos económicos y ambientales durante los próximos años.
PRINCIPALES ASUNTOS
En áreas donde el corvinón ocelado es una especie exótica, el escape de peces cautivos en jaulas y otros contenedores de producción podrían afectar negativamente a la flora y fauna endémicas de la región debido a la competencia por los recursos, tales como alimento y hábitat. Otro problema potencial con el cultivo de especies exóticas en el ambiente natural (vgr. jaulas de redes o corrales) es la transmisión de enfermedades a las poblaciones endémicas, por ejemplo se ha sugerido que la cepa de Streptococcus iniae aislado de los peces silvestres (Pomadasys stridens y Synodus variegatus) capturados en el Golfo de Eilat (Israel), podría haber sido una cepa exótica, introducida por el cortinón ocelado criado en jaulas cercanas.
Las descargas de aguas de las instalaciones basadas en tierra así como el alimento no ingerido/productos de desperdicio de sistemas de producción acuícola abiertos pueden generar impactos ambientales negativos en el entorno. Las medidas que frecuentemente se adoptan para disminuir la cantidad de descargas y/o desperdicios, incluyen el tratamiento de aguas residuales previo a su descarga final (filtración, lagunas de sedimentación), incremento de eficiencia alimenticia y digestibilidad, limitación de la cantidad de producción en áreas sensibles y empleo de sistemas acuícolas de recirculación para el mantenimiento de los pies de cría, cultivo larvario y/o las operaciones de la fase de crecimiento.
Las descargas de aguas de las instalaciones basadas en tierra así como el alimento no ingerido/productos de desperdicio de sistemas de producción acuícola abiertos pueden generar impactos ambientales negativos en el entorno. Las medidas que frecuentemente se adoptan para disminuir la cantidad de descargas y/o desperdicios, incluyen el tratamiento de aguas residuales previo a su descarga final (filtración, lagunas de sedimentación), incremento de eficiencia alimenticia y digestibilidad, limitación de la cantidad de producción en áreas sensibles y empleo de sistemas acuícolas de recirculación para el mantenimiento de los pies de cría, cultivo larvario y/o las operaciones de la fase de crecimiento.
Prácticas de acuicultura responsable
Las practicas de cultivo de corvinón ocelado deben apegarse al Código de Conducta para la Pesca Responsable de la FAO. Estas practicas incluyen el mantenimiento de la diversidad genética, monitoreo de la salud de los peces, prevención de la transmisión de enfermedades, etc., para garantizar el alto valor nutricional del producto y la limitación de los impactos ambientales durante el cultivo de esta especie.
REFERENCIAS
Bibliograf´┐Ża
| Arnold, C.R. 1988. Controlled year-round spawning of red drum Sciaenops ocellatus in captivity. Contributions in Marine Science, 30:65-70. |
| Arnold, C.R., Bailey, W.H., Williams, T.D., Johnson, A. & Lasswell, J.L. 1976. Laboratory spawning and larval rearing of red drum and southern flounder. Proceedings of the Annual Conference of the Southeastern Association of Fish and Wildlife Agencies, 31:437-440. |
| Colorni, A., Diamant, A., Eldar, A., Kvitt, H. & Zlotkin, A. 2002. Streptococcus iniae infections in Red Sea cage-culture and wild fishes. Diseases of Aquatic Organisms, 49: 165-170. |
| Colura, R.L. 1990. Saltwater pond fertilization. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 78-79. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. |
| Craig, S.R., Arnold, C.R. & Holt, G.J. 1994. The effects of enriching live foods with highly unsaturated fatty acids on the growth and fatty acid composition of larval red drum Sciaenops ocellatus. Journal of the World Aquaculture Society, 25:424-431. |
| Crocker, P.A., Arnold, C.R., DeBoer, J.A. & Holt, G.J. 1981. Preliminary evaluation of survival and growth of juvenile red drum (Sciaenops ocellata) in fresh and salt water. Journal of the World Mariculture Society, 12:122-134. |
| Gatlin, D.M, III. 2002. Red drum, Sciaenops ocellatus. In: C.D. Webster & C.E. Lim (eds.), Nutrient Requirements and Feeding of Finfish for Aquaculture, pp. 147-158. CABI Publishing, New York, N.Y., United States of America. |
| Gaylord, T.G. & Gatlin, D.M. III. 1996. Determination of digestibility coefficients of various feedstuffs for red drum (Sciaenops ocellatus). Aquaculture, 139:303-314. |
| Hoese, D.H. & Moore, R.H. 1977. Fishes of the Gulf of Mexico Texas, Louisiana, and adjacent waters. Texas A&M University Press, College Station, Texas, United States of America. 327 pp. |
| Holt, G.J. 1993. Feeding larval red drum on microparticulate diets in a closed recirculating water system. Journal of the World Aquaculture Society, 24: 225-230. |
| Holt, G.J. 1990. Growth and development of red drum eggs and larvae. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 46-50. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. |
| Holt, J., Arnold, C.R. & Riley, C.M. 1990. Intensive culture of larval and post larval red drum. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 53-56. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. |
| Holt, J., Godbout, R. & Arnold, C.R. 1981a. Effects of temperature and salinity on egg hatching and larval survival of red drum, Sciaenops ocellata. Fishery Bulletin,79: 569-573. |
| Holt, J., Johnson, A.G., Arnold, C.R., Fable, W.A. & Williams, T.D. 1981b. Description of eggs and larvae of laboratory reared red drum Sciaenops ocellata. Copeia, 4:751-756. |
| Holt, S.A., Kitting, C.L. & Arnold, C.R.1983. Distribution of young red drums among different sea-grass meadows. Transactions of the American Fisheries Society, 112:267-271. |
| Hong, W. & Zhang, Q. 2003. Review of captive bred species and fry production of marine fish in China. Aquaculture, 227:305-318. |
| Lazo, J.P., Dinis, M.T., Holt, G.J., Faulk, C. & Arnold, C.R. 2000. Co-feeding microparticulate diets with algae: toward eliminating the need of zooplankton at first feeding in larval red drum (Sciaenops ocellatus). Aquaculture, 188:339-351. |
| Lutz, G. 1999. Red Drum: a re-emerging aquaculture species. Aquaculture Magazine, 25(4):38-41. |
| Matlock, G.C. 1990. The life history of red drum. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 1-21. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. |
| McBryde, G. 1994. Financial characteristics of a red drum aquaculture firm with winter nursery production. Aquaculture, 122:107-118. |
| McCarty, C.E., Geiger, J.G., Strumer, L., Gregg, B.A. & Rutledge, W.P. 1986. Marine fish culture in Texas: a model for the future. In: R.H. Stroud (ed.), Fish Culture in Fisheries Management, pp. 249-262. American Fisheries Society, Fish Culture and Fisheries Management Sections, Bethesda, Maryland, United States of America. |
| Neill, W.H. 1990. Environmental requirements of red drum. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 105-108. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. |
| O'Bryen, P.J. & Lee, C.-S. 2003. Management of aquaculture effluents workshop discussion summary. Aquaculture, 226:227-242. |
| Peters, K.M. & McMichael Jr., R.H. 1987. Early life history of the red drum, Sciaenops ocellatus (Pisces: Sciaenidae). Estuaries, 10:92-107. |
| Piedrahita, R.H. 2003. Reducing the potential environmental impact of tank aquaculture effluents through intensification and recirculation. Aquaculture, 226:35-44. |
| Roberts, D.E. Jr. 1990. Photoperiod/temperature control in the commercial production of red drum (Sciaenops ocellatus) eggs. In: G.W. Chamberlain, R.J. Midget, & M.G. Haby (eds.), Red Drum Aquaculture, pp. 35-43. Texas A&M Sea Grant College Program No. TAMU-SG-90-603. College Station, Texas, United States of America. |
| Simmons, E.G. & Breuer, J.P. 1962. A study of redfish Sciaenops ocellata Linnaeus, and black drum Pogonias cromis Linnaeus. Publications Institute Marine Science, University of Texas at Austin, 8:184-211. |
| Tacon, A.G.J. & Forster, I.P. 2003. Aquafeeds and the environment: policy implications. Aquaculture, 226:181-189. |