
|
|||||||||
 |
|
||||||||
FAO. 2009.
Ruditapes philippinarum. In Cultured aquatic species fact sheets. Text by
Goulletquer, P.
Edited and compiled by Valerio Crespi and Michael New. CD-ROM (multilingual). |
|||||||||
IDENTIFICATION
Caractéristiques biologiques
Coquille solide, équivalve. Inéquilatérale, crochets sur la moitié antérieure. Contour assez largement ovalaire. Ligament profondément inséré et non dissimulé. Courbure brune, épaisse et elliptique de la marge dorsale postérieure. Lunule allongée en forme de cœur, claire sans être particulièrement définie, avec de petits éléments rayonnants brun clair et foncé. Ecusson réduit à une simple bordure sur la région postérieure du ligament. Sculpture externe formée de nervures rayonnant et de stries concentriques, ces dernières, particulièrement prononcées sur les marges antérieures et postérieures de la coquille, formant des tubercules verruqueux. Phases de croissance visibles. Trois dents cardinales à chaque valve, une centrale à la valve gauche, et deux, centrale et postérieure, à la valve droite, bifide. Sinus palléal relativement accusé sans être très grand derrière le centre de la coquille. Espace en forme de coin entre le manteau inférieur et la ligne palléale. Marges lisses. De formes et de contours extrêmement variables, blanc, jaune, brun vif, parfois avec des rayons, des macules, des taches ou des zigzags d’un brun plus foncé légèrement lisse. Intérieur de la coquille blanc poli avec une teinte orangée, parfois violacée, sur une large zone sous les umbone.
Galerie d'images
 Récolte de palourdes japonaises en utilisant un petit tracteur en petites parcelles et en sol mou |
 Récolte de palourdes japonaises en utilisant un tracteur équipé d’une lame et d’un tapis roulant (sol dur) |
 Ensemencement sur filet avant de replier la partie droite du filet sur la partie ensemencée |
PROFIL

Contexte historique
La palourde japonaise (aussi connue sous les noms de palourde franche, little-neck ou Manila clam) est une espèce de subtropicale à sud boréale du Pacifique occidental. Elle se rencontre dans les zones tempérées de l’Europe. Des populations à l’état sauvage sont présentes dans les Philippines, dans les Mers de Chine Méridionale et Orientale, en Mer Jaune, en Mer du Japon, en Mer d’Okhotsk et autour des Iles Kouriles méridionales. C’est dans ces régions que son élevage a débuté au départ d’activités traditionnelles de pêche et de la récolte de naissain sauvage.
D’une valeur commerciale élevée, des palourdes japonaises ont été introduites dans plusieurs régions du monde où elles se sont établies d’une façon permanente. Introduites par accident au cours des années 30 sur la côte Pacifique d’Amérique du Nord avec du naissain d’huître creuse du Pacifique, les palourdes japonaises ont progressivement colonisé cette côte, depuis la Californie jusqu’en Colombie Britannique. En plus des pêches publiques, la production en écloseries a favorisé le développement de l’élevage de la palourde japonaise le long de la côte Pacifique. Au début du 20ème siècle, des palourdes japonaises ont également été transplantées du Japon vers les eaux hawaïennes où des populations sauvages existent actuellement. La surpêche et les rendements irréguliers de la palourde croisée d’Europe (Ruditapes decussatus) ont encouragé l’importation de R. philippinarum dans les eaux européennes. En 1972, cette espèce a été introduite en France par l’élevage de naissain en écloserie. D’autres importations d’Oregon (Etats-Unis) vers le Royaume-Uni ont été suivies de nombreux transferts en eaux européennes en vue de son élevage (Portugal, Irlande, Espagne et Italie). De plus, des essais d’aquaculture ont résulté en l’importation de naissain en Polynésie française et dans les Iles Vierges américaines, ainsi qu’en Norvège, Allemagne, Belgique, Tunisie, Maroc et Israël. Pendant les années 80, suite aux importants développements en Europe de son aquaculture basée sur des écloseries, la reproduction naturelle de l’espèce a résulté en une expansion géographique des populations sauvages, en particulier en Italie, en France et en Irlande où les palourdes japonaises se sont révélées être plus résistantes et avoir une meilleure croissance que l’espèce endémique R. decussatus. En conséquence, les populations de R. philippinarum fournissent actuellement la majorité des productions de clams en Europe. Elles sont l’objet de pêches publiques intensives, ce qui les met en compétition avec les produits de l’aquaculture dans de nombreuses régions.
D’une valeur commerciale élevée, des palourdes japonaises ont été introduites dans plusieurs régions du monde où elles se sont établies d’une façon permanente. Introduites par accident au cours des années 30 sur la côte Pacifique d’Amérique du Nord avec du naissain d’huître creuse du Pacifique, les palourdes japonaises ont progressivement colonisé cette côte, depuis la Californie jusqu’en Colombie Britannique. En plus des pêches publiques, la production en écloseries a favorisé le développement de l’élevage de la palourde japonaise le long de la côte Pacifique. Au début du 20ème siècle, des palourdes japonaises ont également été transplantées du Japon vers les eaux hawaïennes où des populations sauvages existent actuellement. La surpêche et les rendements irréguliers de la palourde croisée d’Europe (Ruditapes decussatus) ont encouragé l’importation de R. philippinarum dans les eaux européennes. En 1972, cette espèce a été introduite en France par l’élevage de naissain en écloserie. D’autres importations d’Oregon (Etats-Unis) vers le Royaume-Uni ont été suivies de nombreux transferts en eaux européennes en vue de son élevage (Portugal, Irlande, Espagne et Italie). De plus, des essais d’aquaculture ont résulté en l’importation de naissain en Polynésie française et dans les Iles Vierges américaines, ainsi qu’en Norvège, Allemagne, Belgique, Tunisie, Maroc et Israël. Pendant les années 80, suite aux importants développements en Europe de son aquaculture basée sur des écloseries, la reproduction naturelle de l’espèce a résulté en une expansion géographique des populations sauvages, en particulier en Italie, en France et en Irlande où les palourdes japonaises se sont révélées être plus résistantes et avoir une meilleure croissance que l’espèce endémique R. decussatus. En conséquence, les populations de R. philippinarum fournissent actuellement la majorité des productions de clams en Europe. Elles sont l’objet de pêches publiques intensives, ce qui les met en compétition avec les produits de l’aquaculture dans de nombreuses régions.
Principaux pays producteurs

Principaux pays producteurs de Ruditapes philippinarum (FAO Statistiques des pêches, 2006)
Habitat et biologie
La palourde japonaise (Ruditapes philippinarum) est indigène du Japon, ayant une vaste distribution dans les Océans Indien et Pacifique, depuis le Pakistan jusqu’à la Fédération de Russie (Iles Kouriles). Elle a ensuite été introduite le long de la côte Pacifique nord américaine, les Iles Hawaï et, au cours des 20 dernières années, le long des côtes depuis le Royaume-Uni jusqu’au Bassin méditerranéen.
Les palourdes japonaises sont strictement gonochoriques et leurs gonades sont représentées par du tissu diffus en relation étroite avec le système digestif. La période de reproduction varie selon la zone géographique; elle a généralement lieu entre 20 et 25 °C. Une période de repos sexuel est observée de la fin de l’automne au début de l’hiver. Dans la nature, la gamétogenèse dure de deux à cinq mois, suivie de la reproduction. Une seconde reproduction peut survenir au cours de la même saison, de deux à trois mois plus tard. La phase préhivernale de récupération facilite la prise d’énergie par filtration d’une eau de mer encore riche en matière organique et en phytoplancton. Température et alimentation sont les deux principaux paramètres dont dépend la gamétogenèse, qui peut être initiée entre 8 et 10 °C et accélérée par l’augmentation de la température de l’eau de mer. Sa durée diminue de cinq à deux mois entre 14 et 24 °C. Dans cette gamme de températures, les palourdes japonaises sont prêtes à se reproduire. Bien que la température optimale se situe entre 20 et 22 °C, la température minimum en dessous de laquelle cette espèce ne peut efficacement se reproduire est de 12 °C. La disponibilité en nourriture influence la quantité de gamètes produite. Le développement larvaire dure de deux à quatre semaines avant que le naissain ne se fixe. A ce moment, la longueur de la coquille varie entre 190 et 235 µm. Dans la nature, beaucoup de facteurs externes influencent le succès de cette fixation du naissain, comme par exemple température, salinité et courants. Le déplacement des larves dépend principalement des courants induits par les vents et des courants de marée. Dans les zones naturelles de fixation, l’on peut encourager le recrutement de cette espèce par l’apport de gravillons et de petits morceaux de roche. Les larves se fixent en attachant un byssus à un caillou ou à un morceau de coquille.
Les palourdes japonaises sont strictement gonochoriques et leurs gonades sont représentées par du tissu diffus en relation étroite avec le système digestif. La période de reproduction varie selon la zone géographique; elle a généralement lieu entre 20 et 25 °C. Une période de repos sexuel est observée de la fin de l’automne au début de l’hiver. Dans la nature, la gamétogenèse dure de deux à cinq mois, suivie de la reproduction. Une seconde reproduction peut survenir au cours de la même saison, de deux à trois mois plus tard. La phase préhivernale de récupération facilite la prise d’énergie par filtration d’une eau de mer encore riche en matière organique et en phytoplancton. Température et alimentation sont les deux principaux paramètres dont dépend la gamétogenèse, qui peut être initiée entre 8 et 10 °C et accélérée par l’augmentation de la température de l’eau de mer. Sa durée diminue de cinq à deux mois entre 14 et 24 °C. Dans cette gamme de températures, les palourdes japonaises sont prêtes à se reproduire. Bien que la température optimale se situe entre 20 et 22 °C, la température minimum en dessous de laquelle cette espèce ne peut efficacement se reproduire est de 12 °C. La disponibilité en nourriture influence la quantité de gamètes produite. Le développement larvaire dure de deux à quatre semaines avant que le naissain ne se fixe. A ce moment, la longueur de la coquille varie entre 190 et 235 µm. Dans la nature, beaucoup de facteurs externes influencent le succès de cette fixation du naissain, comme par exemple température, salinité et courants. Le déplacement des larves dépend principalement des courants induits par les vents et des courants de marée. Dans les zones naturelles de fixation, l’on peut encourager le recrutement de cette espèce par l’apport de gravillons et de petits morceaux de roche. Les larves se fixent en attachant un byssus à un caillou ou à un morceau de coquille.
PRODUCTION

Fournisseurs d’expertise en pathologie
De l’assistance peut être obtenue des institutions suivantes:
Cycle de production

Cycle de production de Ruditapes philippinarum
Systèmes de production
Le cycle de production commence avec la phase de reproduction et la production de naissain. Ce dernier peut être obtenu soit en récoltant du naissain sauvage, soit en le produisant en écloserie. La majorité des élevages commerciaux de palourde japonaise sont basés sur la culture à plat en zone intertidale de naissain sauvage ou de naissain produit en écloserie (taille de 2 à 3 mm).
Approvisionnement en naissain sauvage
Tout comme la clam colorée Ruditapes variegata, R. philippinarum est l’une des deux espèces prédominantes et traditionnelles en Chine, où elle est principalement cultivée au départ de naissain sauvage récolté dans les zones sablonneuses de plages vaseuses. Dans ce pays, la récolte de naissain comprend la sélection et la préparation de parcs à naissain, l’éradication des prédateurs et l’entretien de routine. Des techniques ont été développées en vue d’augmenter les quantités de naissain récoltées: des dépressions de faible profondeur (jusqu’à plusieurs hectares de superficie) sont creusées dans la partie basse de la zone intertidale; y sont alors éliminés tous les compétiteurs, grandes algues marines et prédateurs avant d’en égaliser le fond. Ces dépressions sont parfois inoculées avec Chaetoceros, une nourriture convenant aux larves et aux postlarves. Chaque dépression peut être utilisée pour l’élevage de deux à trois lots par an. Environ 75 à 150 millions/ha de naissain (0,5 cm) peuvent être ainsi élevés. En mai de l’année suivante, ces palourdes juvéniles atteignent jusqu’à 1,5 cm ; elles sont alors reparquées à la densité de 1,8 millions/ha pour une année supplémentaire d’élevage afin d’atteindre la taille commercialisable de 3,5 cm (19 à 45 tonnes/ha).
En eaux européennes, l’approvisionnement en naissain provient soit d’écloseries, soit de collectes de naissain sauvage. La disponibilité en naissain sauvage résulte de la tendance de cette espèce à coloniser les zones dans lesquelles elle a été anciennement cultivée au départ de naissain d’écloserie. Au contraire, en Amérique du Nord, l’approvisionnement en naissain est principalement basé sur la production d’écloserie.
Production de naissain en écloserie
Les principales opérations consistent dans: le conditionnement du stock de géniteurs afin de faciliter la gamétogenèse; la reproduction et l’élevage des larves jusqu’à la métamorphose; et le grossissement des juvéniles obtenus jusqu’à la taille requise, soit en nurserie ou directement en mer.
Le conditionnement du stock de géniteurs dure de 30 à 40 jours à 20 °C. La reproduction est induite soit par choc thermique, soit par l’addition de gouttes de sperme ou par stripping. Les œufs fécondés sont filtrés dans un tamis de 40 µm et maintenus dans des conteneurs de 10 litres jusqu’au stade de larve véligère. Les larves sont alors récoltées dans un tamis et réparties dans des conteneurs à la densité de 3 000 ind./litre. Pendant la première semaine, les larves sont nourries chaque jour avec 30 cellules/µl; ensuite, tous les deux jours jusqu’à ce que le stade de métamorphose soit atteint (deux semaines). Pour la reproduction et l’élevage, la salinité doit se situer entre 24 et 35‰ (tolérance 13,5-35‰). Une température de 15 à 28 °C est optimale pour la croissance, bien que l’espèce puisse survivre pour de courtes périodes à 0 °C et à 35 °C. Les larves pédivéligères peuvent être préparées en vue de leur transport: après un tri et un comptage, elles sont placées dans du matériel de transport (nytex, filtre à café en papier), emballé dans plusieurs couches de tissu. Ceci est alors placé dans une boîte de transport calorifugée, avec un sac à glaçon (non en contact avec les larves). Sinon, les larves pédivéligères sont placées en bassins de fixation ou en plateaux de micronurserie, utilisant des grillages en nylon et un système de recirculation d’eau avec échanges fréquents (e.g. tables inondées, downwellers). Chaque fois que les palourdes sont retirées de l’eau, il faut s’assurer qu’elles ne s’assèchent pas ou qu’elles ne se réchauffent de trop.
L’élevage en écloserie nécessite la production d’espèces de microalgues convenant à l’alimentation des larves. Généralement, les espèces phytoplanctoniques utilisées sont des flagellées, comme par exemple Isochrysis galbana, Pavlova lutherii et Tetraselmis suecica ou Platymonas sp. Des combinaisons de flagellées avec des diatomées comme par exemple Skeletonema costatum, Chaetoceros calcitrans, C. gracilis et Thalassiosira pseudonana apportent un régime alimentaire bien équilibré, qui facilite la gamétogenèse et le développement larvaire. La quantité de nourriture dépend de la densité d’élevage des larves.
Bien que les palourdes aient une coquille protectrice, celle-ci se cassera si elle n’est pas manipulée avec douceur pendant le tri et le comptage.
Pour le prégrossissement de naissain jusqu’à une longueur de coquille de 10 à 15 mm, l’on peut employer un système de nurserie avec upwelling. Des palourdes un peu plus grandes (6 à 7 mm) sont placées à la densité de 3 000 ind./m² sur le fond marin, dans une enveloppe de filet de 4 mm de mailles (1,5 x 2 m). D’autres pratiques culturales de prégrossissement existent: placement de naissain de 4 à 5 mm à la densité de 10 000 ind./m² dans des cadres en bois couverts de filet plastique et empilés sous eau les uns sur les autres (Italie); ou dans des cadres en bois recouverts de filet; ou dans des poches de filet placées sur tables dans le bas de la zone de marée de vive-eau (Irlande). En cours de croissance, la densité de stockage est progressivement réduite. Pendant cette phase d’élevage en nurserie, il faut nettoyer les installations de grossissement, faire le calibrage des palourdes et éliminer les prédateurs (crabes par ex.). Bien que l’on puisse utiliser la culture sur plateau pour la première phase de grossissement, la croissance des palourdes est meilleure lorsqu’elles sont élevées dans le sol. Desupwellers flottantstels que FLUPSYS (une table qui supporte une série de conteneurs placés le long d’un chenal central d’où l’eau est propulsée par une hélice ou une roue à aubes) sont principalement utilisés en Amérique du Nord. Les palourdes doivent être régulièrement calibrées afin que tous les animaux soient de la même taille; sinon, la compétition des plus grandes palourdes contribuera à retarder la croissance des plus petites.
Lorsque la longueur de leur coquille atteint 10 à 15 mm, les jeunes palourdes sont prêtes à être transplantées dans le substrat. Leur grossissement se fera de préférence dans une zone intertidale protégée des vents, vagues et marées extrêmes. Alternativement, des parcs à huîtres de 400 m2 peuvent être utilisés pour la culture de palourdes jusqu’à la taille commercialisable. Les substrats qui conviennent pour ce grossissement consistent généralement en gravier, sable, vase et coquillages. Bien que la palourde japonaise puisse survivre dans une variété de sols, un substrat trop mou en rend l’accès difficile et limite le genre d’équipement utilisé pour l’ensemencement, l’élevage et la récolte. Avant l’ensemencement, la zone doit être bien préparée et les prédateurs doivent être éliminés. Le système de culture en parcelle utilise des bandes de matériel maillé qui sont déployées au-dessus des palourdes mises en place; les bords de ces bandes sont labourés en terre le long des bordures de la parcelle afin de contrôler la prédation par les crabes et les oiseaux.
Croissance et survie sont en relation directe avec la densité de stockage. Les petites palourdes (10 à 15 mm) sont ensemencées à la densité de 200 à 300 ind./m2; simultanément, elles sont couvertes avec du filet (mailles de 4 mm, largeur 1,5 m, longueur 300 m) afin de les protéger d’une prédation excessive. En Europe, l’on a développé une machine à ensemencer qui simultanément laboure le filet en terre et met en place les jeunes palourdes. Des déflecteurs à plaques remplissent les tranchées, enfouissant les bordures du filet. Les filets doivent être nettoyés afin de contrôler les salissures et l’envasement. Il faut aussi régulièrement les vérifier pour maintenir leur efficacité contre les prédateurs. Selon la capacité de charge locale, les palourdes atteindront 40 mm en deux à trois ans environ.
En Chine, le naissain de palourdes japonaises (5 à 10 mm) est mis en place à la densité de 35 millions ind./ha, Cependant, cette densité dépend de la taille du naissain et du type de sédiment. Généralement, les parcs à palourdes ne sont pas protégés par des filets.
En Chine, les palourdes sont récoltées après 10 à 16 mois d’élevage, lorsqu’elles ont la taille d’au moins 30 mm. En Europe et en Amérique du Nord, elles sont généralement récoltées après 16 à 30 mois, à une taille supérieure (30 à 40 mm de longueur de coquille) dont la valeur marchande est plus élevée. Dans les deux cas, elles sont généralement récoltées soit par ratissage, soit mécaniquement. En Europe, la récolte manuelle de palourdes japonaises se fait en ratissant le substrat ce qui ramène les palourdes à la surface. La récolte mécanique se fait par succion ou par dragues élévatrices; en sol sablonneux, un tracteur équipé latéralement d’un tapis roulant permet de déterrer les palourdes et de les trier par taille, avec un rendement de plus de 200 m2/h (>600 kg/h).
Une fois récoltées, les palourdes sont mises en boîtes ou en sacs et transportées pour être triées mécaniquement. Ensuite, elles sont généralement conservées à l’état humide afin qu’elles dégorgent sable et autres impuretés avant leur transformation et commercialisation. Elles peuvent être conservées plus longtemps à l’état humide en poches de filet plastique, soit dans le bas des zones intertidales, soit en parcs ou suspendues de radeaux flottants, jusqu’à ce qu’elles soient vendues.
Les coûts de production sont très variables. En fonction des caractéristiques du site, il faut de deux à quatre ans pour que les palourdes atteignent la taille commercialisable, ce qui influence le rendement total. Les principaux autres facteurs influents sont la capacité de charge locale, la consistance du sol et le coût des diverses opérations nécessaires telles que préparation des parcelles à ensemencer, élimination des prédateurs, nettoyage des installations afin d’empêcher leur encrassement par la boue et les algues, calibrages et triages réguliers. De plus, la stratégie choisie pour l’élevage influencera directement les coûts de production. La taille à laquelle acheter le naissain d’une écloserie-nurserie est critique. Le gain réalisé par l’achat de naissain de plus petite taille à un moindre coût peut être annulé par des taux de mortalité plus élevés et par des coûts opérationnels plus élevés (frais de nurserie). Par contre, l’achat de naissain plus grand est plus cher et doit être compensé par des taux de survie plus élevés pour devenir rentable. Les caractéristiques du substrat (sablonneux ou vaseux) influencent les méthodes de récolte et leur efficience; par exemple, la récolte mécanique est plus facile en fonds sablonneux où elle donne de meilleurs rendements. Tous ces facteurs devraient être soigneusement considérés lors de la planification de l’élevage de palourdes afin de minimiser les coûts de production et choisir une stratégie d’élevage appropriée.
Approvisionnement en juvéniles
Approvisionnement en naissain sauvage
Tout comme la clam colorée Ruditapes variegata, R. philippinarum est l’une des deux espèces prédominantes et traditionnelles en Chine, où elle est principalement cultivée au départ de naissain sauvage récolté dans les zones sablonneuses de plages vaseuses. Dans ce pays, la récolte de naissain comprend la sélection et la préparation de parcs à naissain, l’éradication des prédateurs et l’entretien de routine. Des techniques ont été développées en vue d’augmenter les quantités de naissain récoltées: des dépressions de faible profondeur (jusqu’à plusieurs hectares de superficie) sont creusées dans la partie basse de la zone intertidale; y sont alors éliminés tous les compétiteurs, grandes algues marines et prédateurs avant d’en égaliser le fond. Ces dépressions sont parfois inoculées avec Chaetoceros, une nourriture convenant aux larves et aux postlarves. Chaque dépression peut être utilisée pour l’élevage de deux à trois lots par an. Environ 75 à 150 millions/ha de naissain (0,5 cm) peuvent être ainsi élevés. En mai de l’année suivante, ces palourdes juvéniles atteignent jusqu’à 1,5 cm ; elles sont alors reparquées à la densité de 1,8 millions/ha pour une année supplémentaire d’élevage afin d’atteindre la taille commercialisable de 3,5 cm (19 à 45 tonnes/ha).
En eaux européennes, l’approvisionnement en naissain provient soit d’écloseries, soit de collectes de naissain sauvage. La disponibilité en naissain sauvage résulte de la tendance de cette espèce à coloniser les zones dans lesquelles elle a été anciennement cultivée au départ de naissain d’écloserie. Au contraire, en Amérique du Nord, l’approvisionnement en naissain est principalement basé sur la production d’écloserie.
Production de naissain en écloserie
Les principales opérations consistent dans: le conditionnement du stock de géniteurs afin de faciliter la gamétogenèse; la reproduction et l’élevage des larves jusqu’à la métamorphose; et le grossissement des juvéniles obtenus jusqu’à la taille requise, soit en nurserie ou directement en mer.
Le conditionnement du stock de géniteurs dure de 30 à 40 jours à 20 °C. La reproduction est induite soit par choc thermique, soit par l’addition de gouttes de sperme ou par stripping. Les œufs fécondés sont filtrés dans un tamis de 40 µm et maintenus dans des conteneurs de 10 litres jusqu’au stade de larve véligère. Les larves sont alors récoltées dans un tamis et réparties dans des conteneurs à la densité de 3 000 ind./litre. Pendant la première semaine, les larves sont nourries chaque jour avec 30 cellules/µl; ensuite, tous les deux jours jusqu’à ce que le stade de métamorphose soit atteint (deux semaines). Pour la reproduction et l’élevage, la salinité doit se situer entre 24 et 35‰ (tolérance 13,5-35‰). Une température de 15 à 28 °C est optimale pour la croissance, bien que l’espèce puisse survivre pour de courtes périodes à 0 °C et à 35 °C. Les larves pédivéligères peuvent être préparées en vue de leur transport: après un tri et un comptage, elles sont placées dans du matériel de transport (nytex, filtre à café en papier), emballé dans plusieurs couches de tissu. Ceci est alors placé dans une boîte de transport calorifugée, avec un sac à glaçon (non en contact avec les larves). Sinon, les larves pédivéligères sont placées en bassins de fixation ou en plateaux de micronurserie, utilisant des grillages en nylon et un système de recirculation d’eau avec échanges fréquents (e.g. tables inondées, downwellers). Chaque fois que les palourdes sont retirées de l’eau, il faut s’assurer qu’elles ne s’assèchent pas ou qu’elles ne se réchauffent de trop.
L’élevage en écloserie nécessite la production d’espèces de microalgues convenant à l’alimentation des larves. Généralement, les espèces phytoplanctoniques utilisées sont des flagellées, comme par exemple Isochrysis galbana, Pavlova lutherii et Tetraselmis suecica ou Platymonas sp. Des combinaisons de flagellées avec des diatomées comme par exemple Skeletonema costatum, Chaetoceros calcitrans, C. gracilis et Thalassiosira pseudonana apportent un régime alimentaire bien équilibré, qui facilite la gamétogenèse et le développement larvaire. La quantité de nourriture dépend de la densité d’élevage des larves.
Nurserie
Bien que les palourdes aient une coquille protectrice, celle-ci se cassera si elle n’est pas manipulée avec douceur pendant le tri et le comptage.
Pour le prégrossissement de naissain jusqu’à une longueur de coquille de 10 à 15 mm, l’on peut employer un système de nurserie avec upwelling. Des palourdes un peu plus grandes (6 à 7 mm) sont placées à la densité de 3 000 ind./m² sur le fond marin, dans une enveloppe de filet de 4 mm de mailles (1,5 x 2 m). D’autres pratiques culturales de prégrossissement existent: placement de naissain de 4 à 5 mm à la densité de 10 000 ind./m² dans des cadres en bois couverts de filet plastique et empilés sous eau les uns sur les autres (Italie); ou dans des cadres en bois recouverts de filet; ou dans des poches de filet placées sur tables dans le bas de la zone de marée de vive-eau (Irlande). En cours de croissance, la densité de stockage est progressivement réduite. Pendant cette phase d’élevage en nurserie, il faut nettoyer les installations de grossissement, faire le calibrage des palourdes et éliminer les prédateurs (crabes par ex.). Bien que l’on puisse utiliser la culture sur plateau pour la première phase de grossissement, la croissance des palourdes est meilleure lorsqu’elles sont élevées dans le sol. Desupwellers flottantstels que FLUPSYS (une table qui supporte une série de conteneurs placés le long d’un chenal central d’où l’eau est propulsée par une hélice ou une roue à aubes) sont principalement utilisés en Amérique du Nord. Les palourdes doivent être régulièrement calibrées afin que tous les animaux soient de la même taille; sinon, la compétition des plus grandes palourdes contribuera à retarder la croissance des plus petites.
Techniques de grossissement
Lorsque la longueur de leur coquille atteint 10 à 15 mm, les jeunes palourdes sont prêtes à être transplantées dans le substrat. Leur grossissement se fera de préférence dans une zone intertidale protégée des vents, vagues et marées extrêmes. Alternativement, des parcs à huîtres de 400 m2 peuvent être utilisés pour la culture de palourdes jusqu’à la taille commercialisable. Les substrats qui conviennent pour ce grossissement consistent généralement en gravier, sable, vase et coquillages. Bien que la palourde japonaise puisse survivre dans une variété de sols, un substrat trop mou en rend l’accès difficile et limite le genre d’équipement utilisé pour l’ensemencement, l’élevage et la récolte. Avant l’ensemencement, la zone doit être bien préparée et les prédateurs doivent être éliminés. Le système de culture en parcelle utilise des bandes de matériel maillé qui sont déployées au-dessus des palourdes mises en place; les bords de ces bandes sont labourés en terre le long des bordures de la parcelle afin de contrôler la prédation par les crabes et les oiseaux.
Croissance et survie sont en relation directe avec la densité de stockage. Les petites palourdes (10 à 15 mm) sont ensemencées à la densité de 200 à 300 ind./m2; simultanément, elles sont couvertes avec du filet (mailles de 4 mm, largeur 1,5 m, longueur 300 m) afin de les protéger d’une prédation excessive. En Europe, l’on a développé une machine à ensemencer qui simultanément laboure le filet en terre et met en place les jeunes palourdes. Des déflecteurs à plaques remplissent les tranchées, enfouissant les bordures du filet. Les filets doivent être nettoyés afin de contrôler les salissures et l’envasement. Il faut aussi régulièrement les vérifier pour maintenir leur efficacité contre les prédateurs. Selon la capacité de charge locale, les palourdes atteindront 40 mm en deux à trois ans environ.
En Chine, le naissain de palourdes japonaises (5 à 10 mm) est mis en place à la densité de 35 millions ind./ha, Cependant, cette densité dépend de la taille du naissain et du type de sédiment. Généralement, les parcs à palourdes ne sont pas protégés par des filets.
Techniques de récolte
En Chine, les palourdes sont récoltées après 10 à 16 mois d’élevage, lorsqu’elles ont la taille d’au moins 30 mm. En Europe et en Amérique du Nord, elles sont généralement récoltées après 16 à 30 mois, à une taille supérieure (30 à 40 mm de longueur de coquille) dont la valeur marchande est plus élevée. Dans les deux cas, elles sont généralement récoltées soit par ratissage, soit mécaniquement. En Europe, la récolte manuelle de palourdes japonaises se fait en ratissant le substrat ce qui ramène les palourdes à la surface. La récolte mécanique se fait par succion ou par dragues élévatrices; en sol sablonneux, un tracteur équipé latéralement d’un tapis roulant permet de déterrer les palourdes et de les trier par taille, avec un rendement de plus de 200 m2/h (>600 kg/h).
Manipulation et traitement
Une fois récoltées, les palourdes sont mises en boîtes ou en sacs et transportées pour être triées mécaniquement. Ensuite, elles sont généralement conservées à l’état humide afin qu’elles dégorgent sable et autres impuretés avant leur transformation et commercialisation. Elles peuvent être conservées plus longtemps à l’état humide en poches de filet plastique, soit dans le bas des zones intertidales, soit en parcs ou suspendues de radeaux flottants, jusqu’à ce qu’elles soient vendues.
Coûts de production
Les coûts de production sont très variables. En fonction des caractéristiques du site, il faut de deux à quatre ans pour que les palourdes atteignent la taille commercialisable, ce qui influence le rendement total. Les principaux autres facteurs influents sont la capacité de charge locale, la consistance du sol et le coût des diverses opérations nécessaires telles que préparation des parcelles à ensemencer, élimination des prédateurs, nettoyage des installations afin d’empêcher leur encrassement par la boue et les algues, calibrages et triages réguliers. De plus, la stratégie choisie pour l’élevage influencera directement les coûts de production. La taille à laquelle acheter le naissain d’une écloserie-nurserie est critique. Le gain réalisé par l’achat de naissain de plus petite taille à un moindre coût peut être annulé par des taux de mortalité plus élevés et par des coûts opérationnels plus élevés (frais de nurserie). Par contre, l’achat de naissain plus grand est plus cher et doit être compensé par des taux de survie plus élevés pour devenir rentable. Les caractéristiques du substrat (sablonneux ou vaseux) influencent les méthodes de récolte et leur efficience; par exemple, la récolte mécanique est plus facile en fonds sablonneux où elle donne de meilleurs rendements. Tous ces facteurs devraient être soigneusement considérés lors de la planification de l’élevage de palourdes afin de minimiser les coûts de production et choisir une stratégie d’élevage appropriée.
Maladies et mesures de contrôle
| MALADIE | AGENT | TYPE | SYNDROME | MESURES |
| Virose | Herpèsvirus | Virus | Fortes mortalités sporadiques en écloserie | Pas de mesure curative. Prévention et sélection de site; monitoring du transfert des palourdes |
| Rickettsiose | Rickettsia spp. | Bactérie | Microcolonies apparaissent dans les cellules épithéliales des branchies et de la glande digestive; infections généralement légères et non associées avec une maladie; pas d’effet macroscopique |
Pas de mesure curative. Prévention et sélection de site |
| Anneau brun (calcification anormale) | Vibrio tapetis | Bactérie | Croissance ralentie; dépôt brunâtre le long du bord antérieurdu manteau causé par du matériau organique (conchyoline) |
Pas de mesure curative. Prévention et sélection de site; monitoring du transfert des palourdes |
| Perkinsose | Perkinsus atlanticus et organismes de type Perkinsus |
Protozoaire parasite | Nodules ou cystes blanc grisâtre à la surface des tissus du manteau et des branchies dû à une réponse hémocytique; effort reproductif réduit |
Pas de mesure curative. Prévention et sélection de site; monitoring des zones d’élevage et des transferts |
| Cercaires | Cercaria elegans, Cercaria tapidis | Trématode digénétique (forme larvaire) |
Glande génitale colonisée, alors que quelques-uns envahissent l’organe digestif et les régions environnantes; glande génitale très sérieusement affectée; impact négatif sur l’effort reproductif et la croissance |
Pas de mesure curative. Prévention et sélection de site; monitoring du transfert des palourdes |
| – | Proctoeces orientalis |
Trématode digénétique fellostomide | Localisé dans les reins | Pas de mesure curative. Prévention et sélection de site; monitoring du transfert des palourdes |
Fournisseurs d’expertise en pathologie
De l’assistance peut être obtenue des institutions suivantes:
- Laboratoire communautaire de référence (maladies de mollusques bivalves), IFREMER La Tremblade, BP 133, 17390 La Tremblade, France.
- Université de Bretagne occidentale (UBO), Laboratoire LEMAR. IUEM Technopole Brest Iroise, 29280 Plouzane, France.
- Faculty of Applied Marine Science, Cheju National University. 1 Ara 1 Dong, Jeju City, Jeju Do 690-756, République de Corée.
- Instituto de Investigaciones Marinas. Eduardo Capelo 6, 36208 Vigo, Espagne.
- Department of Fisheries & Oceans, Pacific Biological Station. Nanaimo, BC, V9R 5K6 Canada
- CEFAS, Weymouth Laboratory. Barrack Road, The Nothe, Weymouth, Dorset, DT4 8UB Royaume-Uni.
STATISTIQUES
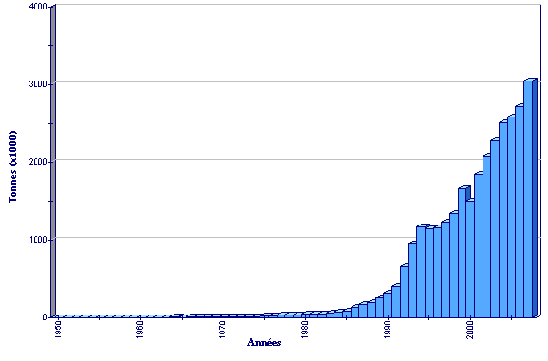
Statistiques de production
Production globale d’aquaculture de Ruditapes philippinarum
(FAO Statistiques des pêches)
(FAO Statistiques des pêches)
Marché et commercialisation
En Chine, la palourde japonaise est l’un des produits comestibles de la mer les plus répandus dans les zones côtières. Elle est généralement vendue à l’état vivant dans les marchés locaux pour environ 0,5 USD/kg. Elle est consommée frite ou en soupe. Les palourdes sont également commercialisées sous la forme de différents produits - congelées en utilisant des individus épurés ou congelées et emballées sous vide dans un sac plastique prêt pour la cuisson au four à micro-ondes. Cette espèce est également exportée vers le Japon. En France et au Royaume-Uni, toutes les palourdes d’élevage sont vendues à l’état frais aux marchés locaux et aux restaurants. En Italie, les palourdes sont vendues sur le marché national mais de grandes quantités sont aussi exportées vers l’Espagne. En Irlande, une demande peu élevée à l’échelle nationale a encouragé les producteurs à les exporter à l’état frais vers la France et l’Espagne. Les quantités pêchées dans les eaux européennes ayant fortement augmenté, le prix des palourdes japonaises a progressivement diminué de 10 USD/kg à 8,5 USD/kg, et ensuite à 5 USD/kg respectivement en 1983, 1987 et les années 90.
SITUATION ET TENDANCES
Aujourd’hui, toutes les pratiques culturales concernant la palourde japonaise (Manila clam) sont bien maîtrisées, y compris la production en écloserie, et l’espèce a été largement utilisée dans le monde. Les caractéristiques biologiques de cette espèce sont favorables à un futur développement. La production aquacole de Ruditapes philippinarum devrait donc augmenter à court terme, soit par l’augmentation des superficies mises en élevage, soit par de nouvelles introductions dans des zones et des pays potentiellement prometteurs. Cependant, le facteur principal qui a modifié la production dans plusieurs pays a été l’impact de maladies. L’on considère que des microorganismes de type Perkinsus ont été responsables du déclin de la production de palourdes japonaises en République de Corée (mortalités annuelles massives en fin d’été depuis le début des années 90), ainsi qu’au Japon et en Chine (Mer Jaune). De plus, la maladie bactérienne de « l’anneau brun » a ralenti la production dans plusieurs pays traditionnellement producteurs (eaux européennes de l’Atlantique). En plus de ces problèmes sanitaires, le développement de populations sauvages résultant de l’introduction de cette espèce a provoqué plusieurs changements dans les tendances de production, soit en facilitant l’approvisionnement en naissain (Italie), soit, au contraire, en créant une compétition économique avec l’élevage (France) et en favorisant les pêches publiques. Le long de la côte occidentale d’Amérique du Nord, des prédateurs exotiques (crabes verts) posent un risque potentiel pour la production commerciale.
PROBLÈMES ET CONTRAINTES MAJEURS
L’occurrence de perkinsoseen République de Corée, au Japon et en Chine pourrait constituer une sérieuse menace pour l’élevage de cette espèce, ainsi que démontré par le déclin actuel de la production coréenne et les mortalités anormales observées dans les eaux européennes méridionales. La production future dépendra de la façon dont des mesures sanitaires seront imposées afin de limiter l’expansion de la maladie. Le long de la côte occidentale d’Amérique du Nord, des prédateurs exotiques (crabes verts) créent un risque potentiel pour la production commerciale.
Considérée comme une espèce exotique et possédant un potentiel d’expansion dans plusieurs pays, la palourde japonaise peut représenter une menace pour la biodiversité locale. L’on a observé l’hybridation naturelle entre l’espèce européenne indigène Ruditapes decussatus et l’exotique R. philippinarum. Comme dans le cas d’autres espèces bivalves filtreuses, l’étendue et l’échelle de l’impact des diverses biotoxines et de l’impossibilité de contrôler les toxines des microalgues sont un facteur limitant pour son élevage. La bioaccumulation de toxines peut déclencher de longues fermetures de l’industrie et des interdictions de vente, ce qui aurait un effet négatif sur l’économie aquacole des mollusques.
Ruditapes philippinarum est devenue récemment un candidat pour la polyculture. Des palourdes ont été cultivées avec des crevettes marines (Marsupenaeus (Penaeus) japonicus et Fenneropenaeus (Penaeus) penicillatus); en étangs d’eau de mer fertilisée, avec des tilapias rouges (Oreochromis mossambicus*O. niloticus); en combinaison avec des crevettes (M. japonicus), du bar européen (Dicentrarchus labrax) et de la dorade royale (Sparus aurata); ainsi que dans les canaux de drainage d’étangs de crevetticulture. L’élevage de R. philippinarum en rotation avec la culture de Porphyra a également été observé. La polyculture s’est révélée être possible et elle permet de réduire les effets de l’aquaculture sur l’environnement.
Considérée comme une espèce exotique et possédant un potentiel d’expansion dans plusieurs pays, la palourde japonaise peut représenter une menace pour la biodiversité locale. L’on a observé l’hybridation naturelle entre l’espèce européenne indigène Ruditapes decussatus et l’exotique R. philippinarum. Comme dans le cas d’autres espèces bivalves filtreuses, l’étendue et l’échelle de l’impact des diverses biotoxines et de l’impossibilité de contrôler les toxines des microalgues sont un facteur limitant pour son élevage. La bioaccumulation de toxines peut déclencher de longues fermetures de l’industrie et des interdictions de vente, ce qui aurait un effet négatif sur l’économie aquacole des mollusques.
Ruditapes philippinarum est devenue récemment un candidat pour la polyculture. Des palourdes ont été cultivées avec des crevettes marines (Marsupenaeus (Penaeus) japonicus et Fenneropenaeus (Penaeus) penicillatus); en étangs d’eau de mer fertilisée, avec des tilapias rouges (Oreochromis mossambicus*O. niloticus); en combinaison avec des crevettes (M. japonicus), du bar européen (Dicentrarchus labrax) et de la dorade royale (Sparus aurata); ainsi que dans les canaux de drainage d’étangs de crevetticulture. L’élevage de R. philippinarum en rotation avec la culture de Porphyra a également été observé. La polyculture s’est révélée être possible et elle permet de réduire les effets de l’aquaculture sur l’environnement.
Pratiques pour une aquaculture responsable
Les événements épizootiques observés en élevage de mollusques ont démontré la nécessité de prendre des mesures préventives afin d’éviter l’expansion de maladies, ce qui inclut:
Code sanitaire pour animaux aquatiques. Perkinsus atlanticus y ayant été mentionné, tous transferts de palourdes devraient se faire avec le plus grand soin. Bien que non mentionné, Vibrio tapetis constitue également un danger et son monitoring est recommandé.
Dans le cas de la palourde japonaise, il est particulièrement important d’appliquer le Code de conduite pour une pêche responsable de la FAO (Article 9 – Développement de l’aquaculture), le Code de conduite pour l’introduction et le transfert d’organismes marins du CIEM et les recommandations pour une aquaculture durable émises dans la Convention sur la diversité biologique.
Les palourdes japonaises ont involontairement colonisé des zones côtières dans plusieurs pays où leur élevage s’est développé. Cette espèce pourrait donc être considérée comme nuisible dans des conditions spécifiques d’environnement.
- Le monitoring de l’état sanitaire des populations de palourdes.
- L’établissement de systèmes de zonage afin de limiter la propagation de parasites.
- L’utilisation de pratiques appropriées de gestion lors du transfert ou de l’introduction d’espèces ayant un potentiel aquacole.
Code sanitaire pour animaux aquatiques. Perkinsus atlanticus y ayant été mentionné, tous transferts de palourdes devraient se faire avec le plus grand soin. Bien que non mentionné, Vibrio tapetis constitue également un danger et son monitoring est recommandé.
Dans le cas de la palourde japonaise, il est particulièrement important d’appliquer le Code de conduite pour une pêche responsable de la FAO (Article 9 – Développement de l’aquaculture), le Code de conduite pour l’introduction et le transfert d’organismes marins du CIEM et les recommandations pour une aquaculture durable émises dans la Convention sur la diversité biologique.
Les palourdes japonaises ont involontairement colonisé des zones côtières dans plusieurs pays où leur élevage s’est développé. Cette espèce pourrait donc être considérée comme nuisible dans des conditions spécifiques d’environnement.
RÉFÉRENCES
Bibliographie
| Barnabe, G. (ed.). 1994. Aquaculture: biology and ecology of cultured species. Ellis Horwood Series in Aquaculture and Fisheries Support, Wiley & Sons, Chichester, UK. 403 pp. |
| Bartley, D.M. 1994. Towards increased implementation of the ICES [International Council for the Exploration of the Sea]/EIFAC [European Inland Fisheries Advisory Commission] codes of practice and manual of procedures for consideration of introduction and transfers of marine and freshwater organisms. 18th Session European Inland Fisheries Advisory Commission (EIFAC), Rome, Italy, 17-25 May. Document N° EIFAC/XVIII/94/inf. 18. FAO, Rome, Italy. 3 pp. |
| Carlton, J.T. 1999. Molluscan invasions in marine and estuarine communities. Malacologia, 41(2):439-454. |
| Choi, K.S., Park, K.I., Lee, K.W. & Matsuoka, K. 2002. Infection intensity, prevalence, and histopathology of Perkinsus sp. in the Manila clam, Ruditapes philippinarum in Isahaya Bay, Japan. Journal of Shellfish Research, 21(1):119-125. |
| ESAV. 1990. Tapes philippinarum: biologia e sperimentazione. Coord. G. Alessandra. Regione Veneto Ente di Sviluppo Agricolo, Regione Veneto, Italy. 299 pp. |
| Gosling, E.M. 2003. Bivalve molluscs: biology, ecology and culture. Fishing New Books, Oxford, England. 443 pp. |
| Goulletquer, P. 1997. A bibliography of the Manila clam Tapes philippinarum. IFREMER, RIDRV-97.02/RA/LA. IFREMER, Tremblade, France.122 pp. |
| Guo, X., Ford, S. & Zhang, F. 1999. Molluscan aquaculture in China. Journal of Shellfish Research, 18(1):19-31. |
| ICES. 1995. Code of practice on the introductions and transfers of marine organisms. ICES Copenhagen, Denmark. 5 pp. |
| ICES. 2004. Trends in important diseases affecting the culture of fish and molluscs in the ICES area, 1998-2002. Cooperative Research Report, No 265, ICES, Copenhagen, Denmark. 33 pp. |
| IFREMER. 1988. Dossier: La Palourde, dossier d'élevage [Clam culture: a guide]. Ifremer edit., Paris, France. 106 pp. |
| MacKenzie, C.L. Jr., Burnell, V.G. Jr., Rosenfield, A. & Hobart, W.L. (eds.). 1997. The history, present condition, and future of molluscan fisheries of North and Central America and Europe. US Dept of Commerce, NOAA Technical Reports 127(1):234 pp; 128(2):217 pp; 129(3):240 pp. NMFS, Washington DC, USA. |
| Manzi, J.J. & Castagna, M. (eds.). Clam mariculture in North America. Developments in Aquaculture and Fisheries Science, 19. Elsevier Press, Amsterdam, Netherlands. 461 pp. |
| Menzel, W. (ed.). 1990. Estuarine and Marine Bivalve Mollusk Culture. CRC Press, Boca Raton, Florida, USA. 362 pp. |
| Turner, G.E. (ed.). 1988. Codes of practice and manual of procedures for consideration of introductions and transfers of marine and freshwater organisms. EIFAC Occasional Paper No. 23. European Inland Fisheries Advisory Commission (EIFAC), FAO, Rome, Italy, 46 pp. |
