ANNEXE VII
AVANT-PROJET DE DIRECTIVES SUR L’UTILISATION DE LA SPECTROMÉTRIE DE MASSE (SM) POUR L’IDENTIFICATION, LA CONFIRMATION ET LA DÉTERMINATION QUANTITATIVE DES RÉSIDUS
- À l'étape 3 de la Procédure Codex
Tests de confirmation
Lorsque les analyses sont effectuées à des fins de contrôle ou de réglementation, il est particulièrement important que des données confirmatoires soient générées avant de signaler des échantillons contenant des résidus de pesticides qui ne sont pas normalement associés avec ces produits ou lorsque les LMR semblent avoir été dépassées. En chromatographie gazeuse, les exemples incluent les réactions des détecteurs à capture d’électrons aux esters de phtalate et des détecteurs sélectifs de phosphore aux composés contenant du soufre et de l’azote.
Les analyses de résidus de pesticides effectuées au moyen de méthodes multirésidus consistent en général en deux phases: dépistage et confirmation. Ce procédé est décrit schématiquement à la figure 2. La première phase consiste à établir la présence des résidus de pesticides probables à partir de l’interprétation des données brutes, en évitant autant que possible les faux négatifs. La seconde phase est la confirmation, qui se concentre sur les pesticides détectés dans la première phase. L’utilisation des résultats à signaler et les décisions de gestion qui en découlent détermineront son importance et les efforts à y consacrer. La technique utilisée pour la confirmation sera choisie en fonction de sa disponibilité, de son coût et du temps dont on dispose. Il s’agira soit d’interpréter de manière plus poussée les données chromatographiques et spectrométriques de masse, soit de recourir à des méthodes utilisant différentes propriétés physico-chimiques du composé, ou de combiner différentes méthodes de dépistage et de détection. Quelques procédures de confirmation sont reprises au tableau 6.
Lorsque des techniques chromatographiques sont utilisées pour le dépistage ou la confirmation, il est essentiel de fixer correctement les intervalles de temps de rétention. Il importe de veiller à ce que l’instrument soit ajusté correctement avant de commencer l’analyse et de tester la validité du système avant chaque lot d’analyse1. La base de données sur les temps de rétention doit être adaptée aux circonstances2. Dans la phase 1, des intervalles de tolérance de 1,5 à 3 pour cent du temps de rétention absolu peuvent être appliqués pour la chromatographie sur colonne capillaire en fonction de la forme du pic. Pour la confirmation du temps de rétention, les intervalles de tolérance absolus augmentent avec le temps de rétention. L’intervalle de tolérance devrait être inférieur à 1 s pour un TR inférieur à 500 s. Pour des temps de rétention situés entre 500 et 5 000 s, un intervalle de 0,2 pour cent du TRT est recommandé. Pour des temps de rétentions supérieurs, un intervalle de 6 s est approprié.
Les tests de confirmation peuvent être quantitatifs et/ou qualitatifs mais, dans la plupart des cas, les deux types d’informations sont exigés. Des problèmes particuliers surviennent quand des résidus doivent être confirmés au seuil de détermination ou à proximité; toutefois, bien qu’il soit difficile de quantifier les résidus à ce niveau, il est essentiel de fournir une confirmation adéquate tant du niveau que de l’identité du résidu.
L’utilité des tests de confirmation dépend du type d’échantillons et des faits antérieurs connus. Certains résidus sont associés à des cultures ou produits spécifiques. Pour une série d’échantillons d’origine similaire contenant des résidus du même pesticide, il peut suffire de confirmer l’identité des résidus sur quelques échantillons choisis au hasard. De même, lorsque l’on sait qu’un pesticide déterminé a été appliqué au produit échantillonné, la confirmation de l’identité du résidu peut être superflue, même s’il vaut mieux confirmer quelques résultats choisis au hasard. Si l’on dispose d’échantillons à blanc, on s’en servira pour déceler la présence éventuelle d’interférents.
L’analyste doit décider de la marche à suivre pour identifier un résidu de façon certaine; il aura tout intérêt à choisir une méthode sur laquelle les interférents auront peu d’effet. Dans le choix de la (des) technique(s), il faudra tenir compte du matériel et de l’expertise dont dispose le laboratoire.
Chromatographie gazeuse / Spectrométrie de masse (CG/SM)
Les données sur les résidus obtenues à l’aide de la spectrométrie de masse peuvent être déterminantes et, si l’on dispose du matériel approprié, cette technique de confirmation est préférable à toute autre. Cette technique est également communément utilisée pour le dépistage des résidus (phase 1). La spectrométrie de masse pour la détermination des résidus est généralement appliquée conjointement avec une technique de séparation chromatographique pour obtenir simultanément des données sur le temps de rétention, le rapport masse/charge des ions et l’abondance. La transmission quantitative d’analytes labiles dans le système chromatographique pose des problèmes similaires à ceux rencontrés avec d’autres détecteurs. Pour la quantification, les ions surveillés devraient être ceux qui sont les plus spécifiques à l’analyte, et les moins sujets à des perturbations tout en offrant un bon rapport signal-bruit.
Lorsque l’on utilise la détection d’ions déterminés, les intervalles de tolérance pour les rapports masse-charge et les temps de rétention fondés sur l’injection de pesticide étalon dans un solvant pur à une concentration proche du niveau critique doivent avoir été établis à ce stade. Les intervalles de tolérance pour les proportions d’ions doivent être de +/- 30 pour cent de la proportion ionique absolue. Lorsque 2 (ou 3) proportions d’ions déterminés se situent dans les intervalles de tolérance établis, le résidu est confirmé3. Pour un petit nombre de pesticides, le spectre de masse peut ne montrer qu’un ion spécifique. Dans ce cas, il faut rechercher une autre confirmation.
Lorsque les ions détectés continuent d’indiquer la présence éventuelle d’un résidu, le résultat peut être signalé comme provisoirement identifié. Cependant, si le résultat doit conduire à une action réglementaire, il faut rechercher une autre confirmation de l’identité de l’analyte. Ceci peut se faire avec le même équipement CG/SM, en injectant des étalons correspondant à la matrice de l’analyte supposé afin de compenser l’influence de la matrice sur la proportion d’ions. Dans ce cas, il faut faire des injections répétées de l’étalon correspondant à la matrice et de l’échantillon suspect. L’écart entre le TRT de l’analyte dans l’étalon et le pic présumé dans l’échantillon doit normalement être inférieur à 0,1 pour cent. Deux proportions d’ions mesurées dans un même échantillon devraient se situer dans l’intervalle de tolérance calculé sur la base des proportions d’ions dans l’étalon correspondant à la matrice. Le résidu est considéré comme confirmé s’il est conforme à la règle générale énoncée ci-dessus. Si les proportions d’ions ne se situent pas au sein des intervalles de tolérance, une confirmation supplémentaire de l’identité peut être obtenue en utilisant des techniques analytiques de substitution dont des exemples sont cités dans le tableau 6.
Une autre confirmation par spectrométrie de masse peut être réalisée en obtenant « le spectre de masse complet moyennant ionisation par impact électronique » (dans la pratique généralement de m/z50 à un niveau dépassant la région des ions moléculaires). L’absence d’ions perturbateurs joue un rôle important pour confirmer l’identité. On aura une confirmation supplémentaire de l’identité i) en utilisant une autre colonne chromatographique; ii) en utilisant une autre technique d’ionisation (par exemple, ionisation chimique); iii) en surveillant d’autres produits de réaction d’ions déterminés par spectrométrie de masse en tandem (SM/SM ou SMn); ou iv) en surveillant certains ions à une résolution de masse accrue.
Les déterminations par spectrométrie de masse devraient satisfaire aux critères de contrôle de la qualité de l’analyse appliqués aux autres systèmes.
CLHP et CLHP-SM
La confirmation des résidus détectés après séparation par CLHP pose généralement plus de problèmes que la chromatographie gazeuse. Si la détection se fait par absorption de rayons UV, la production d’un spectre complet peut fournir une bonne preuve de l’identité. Toutefois, les spectres UV de certains pesticides ne sont pas très utiles pour le diagnostic, étant semblables à ceux produits par de nombreux autres composés possédant des groupes ou structures fonctionnels semblables, et la coélution de composés perturbateurs peut créer des problèmes supplémentaires. Les données obtenues par absorption d’UV à des longueurs d’ondes multiples peuvent appuyer ou réfuter l’identification, mais en général elles ne sont pas suffisamment caractéristiques par elles-mêmes. Les données obtenues par fluorescence peuvent être utilisées pour appuyer celles obtenues par l’absorption de rayons UV. La CLHP-SM peut fournir de bonnes preuves, mais du fait que les spectres produits sont généralement très simples et ne montrent que peu de fragmentation caractéristique, les résultats obtenus avec cette technique n’ont guère de chances d’êtres définitifs. La CLHP-SM/SM est une technique plus efficace, associant sélectivité et spécificité, qui fournit souvent de bonnes preuves de l’identité d’un pesticide. Les techniques CLHP-SM tendent à être sujettes aux effets de matrices, en particulier la suppression, et la confirmation de la quantité peut donc exiger le recours à l’addition d’étalons ou à des étalons isotopiquement marqués. La production de dérivés peut aussi être utilisée pour la confirmation de résidus détectés par la CLHR (tableau 6).
Chromatographie en couche mince (CCM)
Dans certains cas, l’analyse chromatographique en couche mince (CCM) est le moyen le plus commode pour confirmer les résultats de la chromatographie gazeuse. L’identification repose sur deux critères, la valeur Rf et la réaction de visualisation. Les méthodes de détection fondées sur les titrages biologiques (par exemple, enzymes, moisissures, inhibition des chloroplastes) sont particulièrement adaptées à la confirmation qualitative car elles sont spécifiques de certains types de composés, sensibles et normalement très peu affectées par les coextraits4,5. La documentation scientifique existante contient de nombreuses références à cette technique6. Sur le plan quantitatif toutefois, la chromatographie en couche mince donne des résultats limités. Un prolongement de cette méthode consiste à retirer la partie de la plaque correspondant à la valeur Rf du composé, puis à procéder à une élution de la substance à analyser à partir du support, afin de poursuivre la confirmation par analyse chimique ou physique. Il convient de toujours déposer sur la plaque à côté de l’extrait d’échantillon à analyser une tache du pesticide de référence afin d’éviter tout problème de non répétitivité de la valeur Rf. Le dépôt d’une tache de pesticide de référence sur l’extrait peut aussi donner des informations utiles. Les avantages de la chromatographie en couche mince sont: sa rapidité, son faible coût et son applicabilité à des produits sensibles à la chaleur. Ses inconvénients sont: (généralement) une sensibilité et une capacité de séparation inférieures à celles des techniques de détection chromatographiques au moyen d’instruments et la nécessité d’une purification plus efficace dans le cas de détections fondées sur des réactions chromatiques des substances chimiques.
Dérivatisation
Lors de la sélection d’ions pour confirmation par CG/SM fondée sur un dérivé, les ions sélectionnés doivent être structurellement pertinents pour le résidu et ne pas représenter que des fragments de l’agent de dérivatisation. Si la dérivatisation peut être utile pour confirmer l’identité d’un résidu, il ne faut oublier qu’elle ajoute un élément supplémentaire d’incertitude à la confirmation quantitative.
Ces méthodes de confirmation peuvent être réparties en trois groupes principaux.
a) Réactions chimiques
On a souvent eu recours à des réactions chimiques de faible ampleur pour obtenir des produits de dégradation, d’addition ou de condensation des pesticides, qui sont ensuite réexaminés par des techniques chromatographiques. Les réactions donnent des produits présentant des temps de rétention et des réactions aux détecteurs différents du composé d’origine. Un échantillon du pesticide de référence doit être traité parallèlement au résidu présumé, de façon à permettre une comparaison directe des résultats. Un extrait enrichi doit être également inclus afin de prouver que la réaction s’est produite en présence d’un échantillon du produit à analyser. Il peut y avoir une interférence lorsque des dérivés sont détectés au moyen des propriétés du réactif dérivatisant. Un inventaire des réactions chimiques utilisées pour les épreuves de confirmation a été publié par Cochrane, W.P. (Chemical derivatisation in pesticide analysis, Plenum Press, NY (1981)). Les réactions chimiques ont l’avantage d’être rapides et faciles à effectuer, mais il peut être nécessaire d’acheter des réactifs spéciaux et de les purifier.
b) Réactions physiques
Une technique utile est l’altération photochimique d’un résidu de pesticide en vue d’obtenir un ou plusieurs produits ayant un chromatogramme reproductible. Un échantillon du pesticide de référence et un extrait enrichi doivent toujours êtres traités en parallèle. Si les échantillons contiennent plus d’un résidu de pesticide, l’interprétation des résultats peut être difficile. Dans ce cas, on peut au préalable séparer certains résidus par CCM, CLHP ou fractionnement de la colonne.
c) Autres méthodes
De nombreux pesticides sont susceptibles d’être dégradés/transformés par des enzymes. Contrairement aux réactions chimiques normales, ces processus sont très spécifiques et consistent en général en oxydation, hydrolyse ou de-alkylation. Les produits de conversion ont des caractéristiques chromatographiques différentes du pesticide initial et peuvent servir à la confirmation si on les compare aux produits de réaction obtenus avec des pesticides de référence.
Tableau 6. Méthodes de détection appropriées pour le dépistage (phase 1) et la confirmation (phase 2) des résidus
Phase 1 – Dépistage | |||||||||
CG avec colonne capillaire – ECD, NPD, FPD, PFPD |
CG-SM |
CL-SM |
CL-DAD ou dépistage UV |
CL-UV/VIS (longueur d’ondes simple) |
CL-Fluorescence |
CG avec colonne emballée – ECD, NPD, FPD |
CCM – enzyme, croissance fongique ou inhibition des chloroplastes | ||
Phase 2 - Confirmation |
CG – colonne capillaire – ECD, NPD, FPD, PFPD |
x1 |
x1 |
x |
x |
x |
x |
X | |
CG-SM |
x |
x2 |
x |
x |
x |
x |
x |
X | |
CL-SM |
x |
x |
x |
x |
x |
x |
X | ||
Techniques de balayage complet |
x |
x |
x |
x |
x |
x |
x |
X | |
(MS)n, HRMS, techniques d’ionisation alternatives |
x |
x |
x |
x |
x |
x |
x |
X | |
CL-DAD ou balayage UV |
x |
x |
x |
x |
x |
x |
X | ||
CL-UV/VIS (longueur d’ondes simple) |
x |
x |
x |
x |
X | ||||
CL- Fluorescence |
x |
x |
x |
x |
x |
X | |||
CCM – enzyme, croissance fongique ou inhibition chloroplaste |
x |
x |
x |
x |
x |
x |
x |
x3 | |
Dérivatisation |
x |
x |
x |
x |
x |
x |
x |
X | |
Profil d’isomères spécifiques |
x |
x |
x |
x |
x |
x |
x |
||
1 – Utiliser la colonne de polarité différente, qui aboutit à un ordre d’élution différent des résidus et des contaminants éluant à proximité du pic concerné, ou un autre détecteur spécifique.
2 – La même technique CG-SM peut être utilisée pour la phase 2 (confirmation) si des ions différents sont sélectionnés ou si des intervalles de tolérance sont établis à partir des solutions correspondant à la matrice.
3 – Utiliser la phase mobile ou stationnaire de polarité différente.
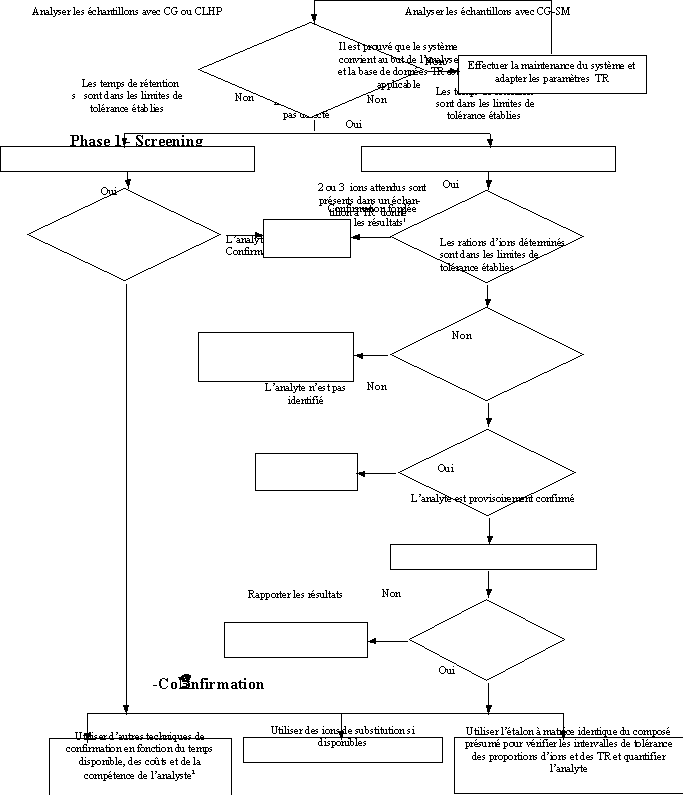
PHASE 1 - DÉPISTAGE
PHASE 2 - CONFIRMATION
Figure 2. Représentation schématique des phases de dépistage et de confirmation (Phase 1 et Phase 2) pour les résidus de pesticides
1 – Valeurs inhabituelles: substances interdites, infraction aux LMR ou études supplémentaires requises comme l’évaluation de l’exposition
2 – Se rapporter au tableau 6 pour d’autres moyens de confirmation
3 – Pour un petit nombre de pesticides, le spectre de masse peut ne montrer qu’un seul ion spécifique. Dans ce cas, il faut changer de méthode de confirmation.
ANNEXE VIII
AVANT-PROJET DE DIRECTIVES POUR L’ESTIMATION DE L’INCERTITUDE DES RÉSULTATS
À l’étape 3 de la Procédure Codex
Selon les directives du CCMAS sur l’incertitude des mesures à l’étape 5 de la procédure Codex, la norme ISO/IEC 17025 exige que les laboratoires déterminent et communiquent l’incertitude associée à chaque méthode d’analyse et à chaque résultat. À cette fin, les laboratoires alimentaires appliquant les directives Codex devraient disposer d’une quantité considérable de données dérivées de la validation/vérification des méthodes, d’études interlaboratoires et d’activités internes de contrôle de qualité pour pouvoir estimer les incertitudes, liées notamment aux méthodes de routine utilisées par le laboratoire.
L’incertitude de la mesure désigne « l’incertitude » attachée aux données générées par un processus de mesure. En chimie analytique, il s'agit généralement de l’incertitude associée au processus de laboratoire, quoiqu’un élément d’incertitude puisse aussi être attribué à l’échantillonnage et à la confirmation qualitative.
« L’estimation » de l’incertitude décrit dès lors la fourchette dans laquelle on peut s’attendre à ce que la vraie valeur se situe avec un niveau défini de probabilité. Il s’agit d’un concept différent de l’erreur de la mesure, laquelle peut être définie comme la différence entre un résultat individuel et la vraie valeur. La signalisation de l’incertitude a pour objet de rassurer sur la validité du résultat signalé.
Les sources d’incertitude sont nombreuses et sont décrites en détail dans les tableaux 1 et 2. L’évaluation de l’incertitude exige en principe une compréhension et une estimation des contributions à l’incertitude de chacune des activités impliquées dans le procédé de mesure.
En général, l’incertitude des mesures découle de nombreux éléments ayant à voir avec la manipulation de l’échantillon. L’incertitude d’un résultat analytique est liée aux trois phases ci-après:
Ø Opérations externes: échantillonnage (SS), emballage, transport et stockage des échantillons7;
Ø Préparation de la prise d’essai: la préparation de l’échantillon et son traitement (SSp);
Ø Analyse (SA): extraction, épuration, évaporation, dérivatisation, détermination instrumentale.
L’incertitude combinée (SRes) et relative (CVL) de l’étalon peut être calculée conformément à la loi sur la propagation d’erreur, comme suit:
![]() ;
; ![]() (1)
(1)
Si la totalité de l’échantillon est analysée, le résidu moyen reste le même et on peut écrire l’équation comme suit :
![]() et CVL =
et CVL = ![]() (2)
(2)
On peut dans la majorité des mesures distinguer trois types d’erreur: erreurs grossières, erreurs aléatoires et erreurs systématiques.
Les erreurs grossières se rapportent à des erreurs non intentionnelles/imprévisibles dans la création du résultat analytique. Ce type d’erreur invalide la mesure. Les procédures d’assurance de la qualité des laboratoires devraient réduire ce genre d’erreurs. Il n’est ni possible, ni souhaitable, d’évaluer statistiquement les erreurs grossières et de les inclure dans l’estimation de l’incertitude. Le présent document n’a pas à traiter ce type d’erreurs.
Les erreurs aléatoires existent dans toutes les mesures et font que les résultats répliqués se situent de part et d’autre de la valeur moyenne. L’erreur aléatoire d’une mesure ne peut pas être compensée, mais en augmentant le nombre d’observations et en donnant une formation plus poussée aux analystes, les effets peuvent en être réduits.
Les erreurs systématiques se retrouvent dans la majorité des expériences, mais leurs effets sont très différents. La somme de toutes les erreurs systématiques dans une épreuve est appelée biais. Étant donné que même sur un grand nombre de mesures cette somme n’est jamais nulle, les erreurs systématiques individuelles ne peuvent pas être détectées directement par des analyses répliquées. Le problème que posent les erreurs systématiques est qu’elles peuvent ne pas être détectées en l’absence de précautions appropriées. Dans la pratique, les erreurs systématiques dans une analyse ne peuvent être identifiées que si la technique analytique est appliquée à un matériau de référence, si l’échantillon est analysé par un autre analyste, ou mieux encore dans un autre laboratoire, ou encore en analysant à nouveau l’échantillon en suivant une méthode différente. Cependant, seul un matériau de référence identique du point de vue de l’analyte, de la matrice et de la concentration répond aux conditions idéales pour déterminer le biais de la méthode. Le biais de la méthode peut aussi être étudié par des études de récupération. Toutefois, ces études ne déterminent que les effets de l’analyse (SA) et ne s’appliquent pas nécessairement aux échantillons prélevés naturellement, ou aux éléments du biais ayant pu être introduits avant la phase analytique. Pour l’analyse des pesticides, les résultats ne sont pas normalement corrigés pour la récupération, mais devraient l’être si la récupération moyenne diffère substantiellement de 100 pour cent. Si le résultat a été corrigé pour la récupération, l’incertitude associée à la récupération devrait être incorporée dans l’estimation de l’incertitude de la mesure.
Des exemples de sources d’erreurs sont donnés dans les tableaux 1 et 2. On notera que toutes les sources mentionnées n’ont pas à être prises en compte. Certaines sources sont déjà intégrées dans l’incertitude générale, tandis que d’autres sont négligeables et peuvent être ignorées. Toutefois, il est important d’identifier et d’évaluer toutes les sources avant de les éliminer. Des informations supplémentaires sont disponibles dans des documents publiés8,9.
Tableau 1: Sources d’erreur dans la préparation de la prise d’essai
Sources d’erreur systématique |
Sources d’erreur aléatoire | |
Préparation de l’échantillon |
La portion de l’échantillon à analyser (échantillon pour analyse) peut ne pas avoir été correctement sélectionnée |
L’échantillon pour analyse est en contact avec, et contaminé par, d’autres portions de l’échantillon |
Le rinçage, le brossage sont effectués différemment, pédoncules et noyaux peuvent avoir été enlevés différemment | ||
Traitement de l’échantillon (SSp) |
Décomposition de l’analyte pendant le traitement de l’échantillon, contamination croisée des échantillons |
Non-homogénéité de l’analyte dans les unités simples de l’échantillon pour analyse |
Non-homogénéité de l’analyte dans l’échantillon pour analyse moulu/coupé | ||
Variation de température pendant le processus d’homogénéisation | ||
Texture (maturité) du matériel végétal affecte le processus d’homogénéisation | ||
Tableau 2: Sources d’erreurs dans l’analyse (SA)
Sources d’erreur systématique |
Sources d’erreur aléatoire | |
Extraction/ |
Récupération incomplète de l’analyte |
Variation dans la composition (par exemple, teneur en eau, graisse et sucre) du matériel d’échantillonnage prélevé dans un produit |
Interférence des matériels coextraits (charge de l’adsorbant) |
Température et composition de l’échantillon/matrice solvant | |
Détermination quantitative |
Interférence des composés coextraits |
Variation du volume nominal des mécanismes dans les intervalles de tolérances autorisés |
Pureté incorrecte de l’étalon analytique |
Précision et linéarité des balances | |
Mesures du poids/volume biaisées |
Réactions de dérivatisation incomplètes et variables | |
Biais causé par l’opérateur dans la lecture des instruments ou de l’équipement analogiques |
Changement dans les conditions environnementales du laboratoire pendant l’analyse | |
Détermination des substances qui ne proviennent pas de l’échantillon (par exemple, contamination par l’emballage) |
Conditions variables d’injection, de chromatographie et de détection (effet de matrice, inertie du système, réaction au détecteur, variation signal-bruit etc.) | |
Détermination de substance différant de la définition du résidu |
Effets dus à l’opérateur (manque d’attention) | |
Calibrage biaisé |
Calibrage | |
Si les laboratoires disposent d’un certain nombre d’options pour l’estimation de l’incertitude de la mesure, les deux procédures les plus courantes sont communément désignées comme l’approche ascendante et l’approche descendante10.
La méthode ascendante:
La méthode ascendante ou approche composante par composante intègre un processus par activité dans lequel l’analyste divise toutes les opérations analytiques en activités primaires. Celles-ci sont ensuite combinées ou regroupées en activités communes et une estimation est faite de la contribution de ces activités à la valeur d’incertitude combinée du processus de mesure. L’approche ascendante peut se révéler très laborieuse et exige une connaissance approfondie de l’ensemble du processus analytique. L’avantage pour l’analyste est que cette approche fait apparaître clairement les activités analytiques qui contribuent substantiellement à l’incertitude de la mesure et qui peuvent dès lors être considérées comme points de contrôle critiques pour réduire ou gérer l’incertitude de mesure dans des applications ultérieures de la méthode.
La méthode descendante:
L’approche descendante se fonde sur la validation de la méthode et la précision à long terme des données dérivées des échantillons de contrôle du laboratoire, des résultats des essais d’aptitude des laboratoires, de la littérature publiée, des données et/ou des essais interlaboratoires. Les estimations de l’incertitude fondées sur des études interlaboratoires peuvent également tenir compte de la variabilité des données entre les laboratoires et constituent probablement l’estimation la plus fiable de la performance de la méthode et de l’incertitude associée à son application. Il importe cependant de reconnaître que les études collectives sont conçues pour évaluer une méthode spécifique et les laboratoires participants, et non pas l’imprécision due à la préparation ou au traitement des échantillons, ceux-ci étant en général fortement homogénéisés.
Les laboratoires d’analyse des résidus de pesticides recherchent normalement plus de 200 résidus dans de nombreux produits, ce qui conduit à un nombre infini de combinaisons. Par conséquent, pour estimer l’incertitude associée à des procédures multirésidus, les laboratoires devraient utiliser une gamme d’analytes et de matrices d’échantillons qui représente correctement les résidus et les produits à analyser, tant en ce qui concerne les propriétés physiques et chimiques que la composition, conformément aux parties pertinentes des Directives révisées concernant les bonnes pratiques de laboratoire, au lieu d’estimer l’incertitude pour chaque combinaison méthode/analyte/matrice.
Pour résumer, les laboratoires devraient utiliser soit leurs propres données de précision à long terme, soit la procédure par activité (calcul composante par composante) pour établir et affiner les données sur l’incertitude.
Dans certaines situations, il peut aussi être utile d’estimer la contribution de la variabilité de l’échantillon à l’incertitude. Ceci exige une connaissance de la variabilité de l’analyte dans le lot d’échantillons dont le laboratoire ou l’analyste ne dispose pas forcément. Les valeurs obtenues par l’analyse statistique de plus de 8 500 données sur les résidus (tableau 4) offrent actuellement la meilleure estimation11. Ces estimations peuvent être intégrées dans la valeur d’incertitude combinée.
De même, il peut être nécessaire de tenir compte de la stabilité des analytes pendant le stockage et le traitement des échantillons si ces activités risquent d’engendrer une variabilité entre les analystes et les laboratoires.
L’estimation de l’incertitude des résultats pour les résidus composites provenant de l’association de plusieurs techniques, comme les isomères structurels et optiques, les métabolites et autres produits de fractionnement, peut exiger une approche différente en particulier lorsque la LMR a été établie pour la somme de tous ou de certains des composants. L’estimation des erreurs aléatoires et systématiques des résultats fondée sur la mesure de pics multiples est expliquée en détail dans une publication récente12, qui devrait être consultée le cas échéant.
4. VALEURS INDICATIVES POUR DES INCERTITUDES ACCEPTABLES
L’établissement de l’écart type d’une série de tests effectués par un laboratoire unique, comme mesure de l’incertitude type, exige des résultats provenant d’un important jeu de données qui n’est pas toujours disponible. Toutefois, pour de plus petites quantités de données, le véritable écart type peut être estimé comme suit:
Le tableau 3 ci-dessous illustre le rapport, selon le nombre d’observations (n), entre les véritables écarts (σ), les écarts types calculés (S) et l’étendue probable de la valeur moyenne (
Tableau 3: Les valeurs de f pour le calcul des étendues probables de l’écart type et des valeurs moyennes
n |
Smin=f1σ |
Smax=f2σ |
|
f1 |
f2 |
f3 | |
5 |
0,35 |
1,67 |
1,24 |
7 |
0,45 |
1,55 |
0,92 |
15 |
0,63 |
1,37 |
0,55 |
31 |
0,75 |
1,25 |
0,37 |
61 |
0,82 |
1,18 |
0,26 |
121 |
0,87 |
1,13 |
0,18 |
Les valeurs indicatives de l’incertitude type, présentées dans le tableau 4 sont fondées sur un grand nombre de données et peuvent être utilisées pour vérifier l’exactitude de l’incertitude estimée pour un laboratoire donné et éviter ainsi une valeur déraisonnablement élevée ou faible.
Tableau 4: Incertitudes typiques aux principales étapes de l’analyse des résidus de pesticides
Procédure |
Incertitude relative |
Observations |
Échantillonnage de produits d’origine végétale
|
Produits de dimensions réduites ou moyennes (Taille de l’échantillon ≥10)a: 26-30%b |
Pour tester la conformité avec les LMR, l’incertitude liée à l’échantillonnage est 0, la LMR se référant à la moyenne des résidus dans les échantillons en vrac. |
Produits de grandes dimensions.
| ||
Échantillonnage de produits d’origine animale |
La relation entre le nombre d’échantillons (n) prélevés pour détecter un pourcentage spécifique d’infraction (βp) avec une probabilité (βt), est décrite para: 1-βt = (βp) |
Les échantillons primaires devraient être prélevés au hasard dans l’ensemble du lot. |
Traitement de l’échantillon
|
Varie largement en fonction de la matrice d’échantillon et du matériel. Aucune valeur typique ne peut être fournie. Les analystes doivent essayer de la maintenir en dessous de 8-10%. |
Peut être influencée par le matériel utilisé pour découper/homogénéiser l’échantillon et la matrice, mais est indépendante de l’analyte. |
Analyse
|
La reproductibilité à l’intérieur du laboratoire: 16-53% pour des concentrations de 1μg/kg à 1 mg/kgc.
|
Le CVA typique peut être aisément déterminé à partir des études de récupération réalisées avec différentes combinaisons pesticides–produits à des dates différentes et pendant l’utilisation de la méthode. |
Notes:
a) Secrétariat du Codex. Méthode d’échantillonnage recommandée pour la détermination des résidus de pesticides aux fins du respect des LMR, ftp://ftp.fao.org/codex/standard/en/cxg_033e.pdf
b) Ambrus A. Soboleva E. Contribution de l’échantillonnage à la variabilité des données sur les résidus; www.iaea.org/trc
c) Secrétariat du Codex, Directives révisées concernant les bonnes pratiques de laboratoire pour l’analyse des résidus, ftp://ftp.fao.org/codex/alinorm03/al03_41e
d) Alder L., Korth W., Patey A., van der Schee et Schoeneweis S., Estimation de l’incertitude de la mesure dans l’analyse des résidus de pesticides, J. AOAC International, 84, 1569-1578, 2001.
En plus des incertitudes estimées par les laboratoires individuels, les autorités chargées de la réglementation et d’autres gestionnaires de risques peuvent décider d’une incertitude de mesure élargie par défaut utilisable pour juger du respect des LMR (voir section 5) en fonction des valeurs de reproductibilité interlaboratoires. Ainsi, une incertitude élargie de 50 pour cent pour CVL est considérée comme une valeur par défaut raisonnable.
5. UTILISATION DES INFORMATIONS SUR L’INCERTITUDE
Si nécessaire, le résultat doit être signalé avec l’incertitude élargie, U, comme suit:
Résultat = x ± U (unités)
L’incertitude élargie, U, peut être calculée à partir de l’incertitude type combinée (SRes) avec un facteur de couverture 2, comme recommandé par EURACHEM, ou avec la valeur Étudiant t pour le niveau de fiabilité requis (normalement 95 pour cent) là où le niveau de liberté effectif est inférieur à 20. L’incertitude élargie se calcule alors comme suit:
U = 2SRes or U = tν,0.95SRes
La valeur numérique des résultats signalés devrait suivre la règle générale, selon laquelle le dernier chiffre peut être incertain. On ne devrait arrondir les résultats qu’au stade du résultat final car si on le fait pendant les phases initiales du calcul, on risque d’introduire un biais dans les valeurs calculées.
ANNEXE IX
APPENDICE 2: PROPOSITION VISANT À REGROUPER DES GROUPES DE PRODUITS
FC Groupe 1 Agrumes
• Agrumes de petite taille (par ex. citrons, limes et mandarines)
• Agrumes de grande taille (par ex.. oranges, pamplemousses, pomelos)
(La répartition des produits entre les deux groupes pourrait poser problème car il existe pour chaque plante cultivée de très nombreuses variétés pouvant entrer aussi bien dans la catégorie des agrumes de petite taille que dans celle des agrumes de grande taille).
FB Baies et autres petits fruits
• 4-1 Framboises et mûres (par ex. mûres de ronce, framboises, mûres des haies)
• 4-2 Baies d’arbrisseau (par ex. airelles, cassis et groseilles vertes)
• 4-3 Autres petites baies fruitées (par ex. raisins, fraises)
VA groupe 9 Légumes bulbeux
• 9-1 Bulbes (par ex. oignons, échalotes)
• 9-2 Légumes bulbeux entiers (par ex. oignons de printemps) (légumes entiers sans racines)
VB groupe 10 Légumes du genre Brassica
• 10-1 Choux à rameaux florifères (par ex. chou-fleur, brocoli)
• 10-2 Choux cabus (par ex. chou, blanc, rouge)
• 10-3 Légumes feuillus du genre Brassica (ancien code des légumes feuillus, par ex. chou chinois, verts de moutarde)
kohlrabi?
VC groupe 11 Légumes-fruits, Cucurbitacées
• 11-2 à peau comestible (par ex. concombre, courgette)
• 11-2 à peau non comestible (par ex. melon, potiron)
VO groupe 12 Légumes-fruits, autres que les Cucurbitacées
• 12-1 Solanacées (par ex. tomates, piments)
• 12-2 Champignons
VL groupe 13 Légumes feuillus (y compris légumes feuillus du genre Brassica) devient Légumes-feuillus , sauf légumes feuillus du genre Brassica
VR groupe 16 Légumes-racines et tubercules
Un nouveau groupe proposé pour les feuilles des légumes-racines et tubercules ou les verts ou les feuilles devrait être ajouté au groupe des légumes feuillus et aux aliments pour animaux (verts de la betterave à sucre).
GC groupe 20 Céréales
• 20-1 Petites céréales (par ex. millet, teff)
• 20-2 Céréales (par ex. blé, orge, riz)
• 20-3 Céréales immatures (par ex. maïs doux)
APPENDICE 3: AUTRES AMENDEMENTS (SYNONYMES, NOMS SCIENTIFIQUES, EXTENSION DES CODES, REGROUPEMENTS
Les États membres sont invités à proposer des substances chimiques qui, à leur avis, sont à inclure dans les listes de priorités en se conformant à la procédure suivante:
1.1 Critères régissant l'inscription d'une substance chimique sur la liste des priorités
Pour qu'un pesticide soit considéré apte pour insertion dans la liste de priorités, celui-ci doit:
a) être disponible comme produit commercial;
b) ne pas avoir déjà été accepté pour examen.
Pour satisfaire aux critères d'inscription sur la liste de priorités, l'utilisation du pesticide doit donner lieu à la formation de résidus dans ou sur un produit destiné à l’alimentation humaine ou animale faisant l'objet d'échanges internationaux, dont la présence suscite (ou pourrait susciter) des craintes pour la santé publique et donc occasionne (ou est susceptible d'occasionner) des problèmes au niveau des échanges internationaux.
1.2 Critères de sélection des produits alimentaires pour lesquels le Codex devrait fixer des limites maximales de résidus (LMR) ou des limites de résidus d'origine étrangère (LMRE)
Le produit pour lequel on demande la fixation par le Codex d'une LMR ou d'une LMRE doit être susceptible de contenir des résidus de pesticides et faire l'objet d'échanges internationaux. Les produits constituant une proportion appréciable du régime alimentaire ont un rang de priorité plus élevé.
Il est recommandé aux gouvernements de s'assurer que le pesticide en question ne fait pas déjà partie du système Codex.
NOTE: Une liste de combinaisons pesticide/produit alimentaire déjà incluses dans le Système Codex ou faisant l'objet d'un examen figure dans un document de travail élaboré et utilisé comme base de discussions par le Comité du Codex sur les résidus de pesticides à chacune de ses sessions. Veuillez consulter le document relatif à la dernière session, qui vous permettra de savoir si un pesticide donné a déjà été examiné.
Si le pesticide ne fait pas partie du Système Codex, les gouvernements sont invités à préparer une proposition d’évaluation en remplissant la section sur les “Informations relatives aux pesticides à l’intention du CCPR” ci-après.
Ce faisant:
i) vérifier auprès du(des) fabricant(s) qu'il existe des données suffisantes sur la toxicité et les résidus et s'assurer que le(s) fabricant(s) est(sont) prêt(s) à soumettre des données à la JMPR et en quelle année, et
ii) transmettre l'information au groupe de travail ad hoc sur les priorités en utilisant pour cela le formulaire de la section "Informations relatives aux pesticides à l'intention du Comité du Codex sur les résidus de pesticides", avec copie au Secrétaire de la Commission du Codex Alimentarius.
2.1 Nouvelles substances chimiques
Pour les nouvelles substances chimiques, les informations relatives au critère de substance “plus sûre” ou à “moindre risque”devront être fournies en remplissant le point 6 “Justification d’emploi” de la section sur les Informations relatives aux pesticides à l’intention du CCPR ci-après.
Le pays soumettant une proposition de nouvelle substance est invité à fournir les informations suivantes:
• Les noms de la ou des substance(s) chimique(s) que la substance proposée devrait remplacer;
• Un résumé des calculs de l’exposition aiguë et chronique par le régime alimentaire pour tous les régimes alimentaires pris en compte par le CCPR;
• Autres informations pertinentes à l’appui des nouvelles substances chimiques proposées au titre de produit de remplacement.
2.2 Réévaluation périodique
2.2.1 Les substances chimiques n'ayant pas fait l'objet d'une analyse de toxicité depuis plus de 15 ans et/ou d'un examen approfondi de leurs limites maximales pendant 15 ans du fait de la lourde charge de travail de la JMPR seront proposées au Groupe de travail ad hoc sur les priorités pour réévaluation.
2.2.2 Les gouvernements pourraient vouloir proposer la revaluation d’un pesticide et le faire conformément à la section sur les Informations relatives aux pesticides à l’intention du CCPR ci-après.
2.3 Évaluation
Lorsque le pesticide a déjà été évalué par la JMPR et que des limites maximales de résidus (LMR), des limites maximales de résidus d'origine étrangère (LMRE) ou des teneurs indicatives (TI) ont été fixées, les cas suivants peuvent se présenter:
2.3.1 La JMPR peut relever une carence des données dans une réévaluation périodique ou une évaluation de nouvelle substance chimique.
Dans ce cas, les industriels ou autres parties intéressées peuvent s’engager à fournir des informations au co-secrétaire concerné de la JMPR, avec copie au président du Groupe de travail sur les priorités. Après inscription au calendrier provisoire de la JMPR, les données fournies par les industriels ou autres parties intéressées devront être soumises au co-secrétaire concerné de la JMPR.
2.3.2 Le CCPR peut placer une substance chimique dans le cadre de la règle des quatre ans. Dans ce cas, le gouvernement ou les industriels devront communiquer leur appui pour les limites Codex spécifiques, au Secrétaire FAO de la JMPR, avec copie au président du Groupe de travail sur les priorités. Après inscription au calendrier provisoire de la JMPR, toutes les données à l’appui du maintien de la ou des limites Codex devront être soumises au Secrétaire FAO de la JMPR.
2.3.3 Un État membre ou des industriels peuvent souhaiter élargir l’emploi d’une substance chimique faisant déjà partie du système Codex; c’est-à-dire obtenir des LMR pour un ou plusieurs nouveaux produits alors qu’il existe déjà des limites Codex pour d’autres produits. La demande aux fins d’examen devra être adressée au secrétaire FAO de la JMPR avec copie au président du Groupe de travail sur les priorités. Après inscription au calendrier provisoire de la JMPR, les données devront être transmises au secrétaire FAO de la JMPR.
2.3.4
Un État membre ou des industriels peuvent souhaiter élargir l’application d’une limite Codex en vigueur. Par exemple, une nouvelle BPA peut nécessiter une LMR plus élevée. Dans ce cas la demande devra être adressée au secrétaire conjoint de la FAO, avec copie au président du groupe de travail sur les priorités. Après inscription au calendrier provisoire de la JMPR, les données devront être transmises au secrétaire FAO de la JMPR.
2.3.5 Lorsque le CCPR demande des éclaircissements ou un nouvel examen à propos d’une recommandation de la JMPR, le secrétaire conjoint approprié inscrira la demande au calendrier de la JMPR suivante.
2.3.6 Lorsqu'un pesticide donné suscite de graves inquiétudes en matière de santé publique, les gouvernements membres doivent en informer rapidement le Secrétaire OMS de la JMPR et transmettre les données pertinentes.
3.1 Nouvelles substances chimiques
Lors de l'établissement de priorités relatives aux nouvelles substances chimiques dont l'évaluation est proposée à la JMPR, le Comité doit prendre en compte les critères suivants:
1. La substance chimique présente un risque de toxicité grave ou chronique moindre pour la santé humaine par rapport à d'autres substances chimiques figurant dans sa classification (insecticide, fongicide, herbicide);
2. Date de la soumission de proposition;
3. Date à laquelle les données seront communiquées (disponibilité des données);
4. disponibilité d'examens aux niveaux international et national, et coordination avec d'autres listes nationales/internationales;
5. Prévoir d'évaluer autant de nouvelles substances chimiques que de substances chimiques faisant l'objet d'une réévaluation périodique.
3.2 Réévaluation périodique
Lors de l'établissement de priorités relatives à la réévaluation périodique des substances chimiques par la JMPR, le Comité doit prendre en compte les critères suivants:
1. Substances chimiques n'ayant pas fait l'objet d'une analyse de toxicité depuis plus de 15 ans et/ou d'un examen approfondi de leurs limites maximales pendant 15 ans du fait de la lourde charge de travail de la JMPR;
2. Année d'inscription du produit sur la liste des substances chimiques proposées pour une réévaluation périodique -Non encore prévue;
3. Date à laquelle les données seront communiquées,
4. Le cas échéant, la consommation ou le profil toxicologique indiquent un niveau élevé de risque pour la santé humaine;
5. Le cas échéant, le CCPR a été informé par un gouvernement national que la substance est à l'origine de perturbations au niveau des échanges commerciaux;
6. Il existe une substance chimique étroitement apparentée pour laquelle une réévaluation périodique est proposée et qui est susceptible d'être évaluée parallèlement;
7. Prévoir d'évaluer autant de nouvelles substances chimiques que de substances chimiques faisant l'objet d'une réévaluation périodique.
3.3 Évaluations
Lors de l'établissement de priorités relatives aux évaluations de résidus par la JMPR, le Groupe de travail sur les priorités prendra en compte les critères suivants:
1. Date de réception de la demande;
2. Date de transmission des données;
3. Le cas échéant, si les données sont soumises dans le cadre de la règle des 4 ans régissant les évaluations de données supplémentaires;
4. La nature des données à soumettre.
pour évaluation _________________________
pour réévaluation _________________________
1. NOM:
2. FORMULE DÉVELOPPÉE:
3. APPELLATION CHIMIQUE:
4. NOM COMMERCIAL:
5. NOM ET ADRESSE DES FABRICANTS D'ORIGINE:
6. JUSTIFICATION D'EMPLOI:
7. EMPLOIS: PRINCIPAUX
SECONDAIRES
8. PRODUITS DE BASE FAISANT L'OBJET D'UN COMMERCE INTERNATIONAL ET TENEURS EN RÉSIDUS:
9. PAYS OÙ LE PESTICIDE EST HOMOLOGUÉ:13
10. LIMITES MAXIMALES NATIONALES DE RÉSIDUS:
11. PRODUITS DE BASE POUR LESQUELS L'ÉTABLISSEMENT DE LIMITES MAXIMALES DE RÉSIDUS (LMR) EST PRÉCONISÉ:
12. PRINCIPAUX PROFILS D'EMPLOIS INTERNATIONAUX:
13. LISTE DE DONNÉS DISPONIBLES (TOXICOLOGIE, MÉTABOLISME, RÉSIDUS)
14. DATE DE SOUMISSION POSSIBLE DES DONNÉS À LA JMPR:
15. PROPOSITION D'INCLUSION SOUMISE PAR (PAYS)
On trouvera ci-après la liste provisoire des substances à évaluer par la Réunion conjointe FAO/OMS d'experts sur les résidus de pesticides (JMPR) entre 2004 et 2013
JMPR DE 2004
JMPR DE 2005
JMPR DE 2006
JMPR DE 2007
JMPR DE 2008
JMPR DE 2009
JMPR DE 2010
JMPR DE 2011
JMPR DE 2012
Évaluations de toxicité |
Évaluations de résidus |
Nouvelles substances |
Nouvelles substances |
Réévaluations périodiques |
Réévaluations périodiques |
aldicarbe (117) | |
cycloxydim (179) | |
dithianon (028) | |
fenbutatin oxyde (109) | |
Évaluations |
Évaluations |
JMPR DE 2013
Évaluations de toxicité |
Évaluations de résidus |
Nouvelles substances |
Nouvelles substances |
Réévaluations périodiques |
Réévaluations périodiques |
dichlorvos (025) | |
dicofol (026) | |
diquat (031) | |
étofenprox (184) | |
fenpropathrine (185) | |
Évaluations |
Évaluations |
APPENDICE I
SUBSTANCES PROPOSÉES POUR INSCRIPTION DANS LA LISTE DE PRIORITÉS MAIS DEVANT FAIRE L'OBJET D'UN EXAMEN AVANT PRISE DE DÉCISION.
DDT (LMRE)
Gentamicine, oxytétracycline hydrochoride
LMR pour différents pesticides sur les épices sur la base des données de suivi.
ANNEXE XII
AVANT-PROJETS ET PROJETS RéVISéS DE LIMITES MAXIMALES DE RéSIDUS POUR LES PESTICIDES
(Maintenus aux étapes 7 et 4)
LMR (mg/kg) |
Étape |
Note | |||||
AL |
1021 |
Luzerne fourragère (en vert) |
5 |
poids frais |
4 |
|
MO |
1280 |
Rognons de bovins |
1 |
4 |
||
MO |
1281 |
Foie de bovins |
0,5 |
4 |
||
MM |
812 |
Viande de bovins |
0,05 |
4 |
||
ML |
812 |
Lait de bovins |
0,3 |
4 |
||
PE |
0840 |
Œufs de poule |
0,01 |
(*) |
7 |
|
PM |
0840 |
Chair de volaille |
0,01 |
(*) |
7 |
|
PO |
0840 |
Abats comestibles de volaille |
0,05 |
7 |
||
SO |
0691 |
Graine de coton |
0,2 |
7 |
||
OC |
0691 |
Huile de coton non raffinée |
0,5 |
7 |
||
AM |
1051 |
Betterave fourragère |
0,3 |
7 |
||
AV |
1051 |
Betterave fourragère (fanes ou verts) |
0,3 |
poids frais |
4 |
|
SO |
0697 |
Arachide |
0,05 |
7 |
||
VP |
0063 |
Pois (gousses et graines vertes = immatures) |
0,2 |
7 |
||
VR |
0589 |
Pomme de terre |
0,1 |
7 |
||
VD |
0070 |
Légumes secs |
0,2 |
7 |
||
SO |
0495 |
Graine de colza |
2 |
7 |
||
OC |
0495 |
Huile de colza non raffinée |
5 |
7 |
||
OR |
0495 |
Huile comestible de colza |
5 |
7 |
||
CM |
1206 |
Son de riz non transformé |
0,02 |
(*) |
7 |
|
CM |
0649 |
Riz décortiqué |
0,02 |
(*) |
7 |
|
CM |
1205 |
Riz poli |
0,02 |
(*) |
7 |
|
OC |
0541 |
Huile de soja non raffinée |
0,2 |
7 |
||
OR |
0541 |
Huile comestible de soja |
0,2 |
7 |
||
VR |
0596 |
Betterave sucrière |
0,3 |
7 |
||
AV |
596 |
Betterave sucrière (feuille ou fane) |
0,3 |
poids frais |
4 |
|
SO |
0702 |
Graine de tournesol |
0,2 |
7 |
||
MM |
0812 |
Viande de bovins |
0.1 |
(graisse) |
7 |
|
ML |
0812 |
Lait de bovins |
0.0005 |
(*) |
7 |
|
MO |
0812 |
Abats comestibles de bovins |
0.01 |
(*) |
7 |
|
VR |
0589 |
Pomme de terre |
30 |
Po |
7 |
|
1 Soboleva E. Ambrus A., Application of system suitability test for quality assurance and performance optimization of a gas chromatographic system for pesticide residue analysis, J. Chromatogr. A. 1027. 2004. 55-65.(Application d’un système de test approprié pour la garantie de qualité et l’optimisation des systèmes chromatographiques gazeux pour l’analyse des résidus de pesticides).
2 Lantos J., Kadenczki L., Zakar F., Ambrus A. Validation of gas chromatographic Databases for qualitative identification of active ingredients of pesticide residues in Fajgelj A. Ambrus A. (eds) Principles of Method Validation, Royal Society of Chemistry, Cambridge, 2000, pp 128-137. (Validation de la base de données chromatographique pour identification des ingrédients actifs de résidus de pesticides).
3 Soboleva E. Ahad K. Ambrus A. Applicability of some MS criteria for the confirmation of pesticide residues, http://www.iaea.org/trc (Applicabilité de certains critères SM à la confirmation des résidus de pesticide).
4 Ambrus1* Á., Füzesi2 I., Susán2 M., Dobi3 D., Lantos4 J., Zakar5 F., Korsós4 I., Oláh3 J., Beke3 B.B. and L. Katavics5 A cost effective screening methods for pesticide residue analysis in fruits, vegetables and cereal grains, J. Environ Sci. Health B39 2004 accepted for publication.(Méthodes de séparation rentables pour l’analyse des résidus de pesticides dans les fruits, les légumes et les céréales).
5 Ambrus Á., Füzesi I., Lantos J., Korsos I., Hatfaludi T. Repeatability and Reproducibility of Rf and MDQ Values with Different TLC Elution and Detection Systems. J. Environ Sci. Health B39 2004 accepted for publication. (Répétabilité et reproductibilité des valeurs Rf et MDQ avec différents systèmes CCM d’élution et de détection).
6 IUPAC Report on Pesticides (13) (Bátora, V., Vitorovic, S.Y., Thier, H.-P. and Klisenko, M.A.; Pure & Appl. Chem., 53, 1981, 1039-1049 (Rapport sur les pesticides).
7 L’emballage, le transport, le stockage et la préparation des échantillons peuvent avoir une influence importante sur les résidus détectés, mais leur contribution à l’incertitude est souvent difficile à quantifier en se fondant sur les informations disponibles. Les erreurs se produisent par exemple au stade de la sélection de l’échantillon, ou bien à cause de la période d’échantillonnage, d’un étiquetage incorrect, de la décomposition des analytes ou de la contamination de l’échantillon.
8 EURACHEM Guide to Quantifying Uncertainty in Analytical Measurements, 2e ed. 1999, (Guide pour quantifier l’incertitude dans les mesures analytiques) http://www.measurementuncertainty.org
9 Ambrus A. Reliability of residue data, Accred. Qual. Assur. 9, pp. xx. 2004 (Fiabilité des données sur les résidus).
10 ISO, Guide to the Expression of Uncertainty in Measurement, ISO. Geneva, 1993 (Guide pour l’expression de l’incertitude de la mesure).
11 Ambrus A and Soboleva E. Contribution of sampling to the variability of residue data; www.iaea.org/trc (Contribution de l’échantillonnage à la variabilité des données sur les résidus).
12 Soboleva E., Ambrus A., Jarju O., Estimation of uncertainty of analytical results based on multiple peaks, J. Chromatogr. A. 1029. 2004, 161-166 (Estimation de l’incertitude des résultats analytiques fondée sur des pics multiples).
13 Les pays doivent fournir des informations détaillées sur l’état d’avancement de l’homologation d’une substance chimique au moment de la demande d’inclusion de celle-ci sur les listes de priorité et à nouveau au moment de l’inscription de la substance chimique au calendrier de la JMPR pour examen.