De nombreuses espèces de coléoptères s'attaquent aux arbres dans les zones arides de l'ancien monde. La majorité se nourrissent occasionnellement des feuilles et des fleurs, d'autres attaquent les racines, ou ont des larves qui creusent des galeries dans le tronc et les branches. Mais c'est de ses semences que l'arbre dépend pour assurer sa descendance; les coléoptères dont les larves dévorent les graines menacent donc la survie de l'espèce.

Planche 1 Bruchidé adulte du type vivant sur les acacias (Dimensiones réelles: 2.5 – 3.0 mm)
Cette famille de coléoptères est celle qui exerce la plus grande influence sur les légumineuses arborescentes et arbustives des régions tropicales. Il est par conséquent indispensable, pour la protection des espèces d'Acacia considérées dans le présent projet, de savoir reconnaître les insectes appartenant à ce groupe ainsi que leurs dégâts, et d'avoir des notions suffisantes sur les caractéristiques essentielles de leur cycle biologique.
Cette famille est considérée par la plupart des auteurs comme très voisine des crysomélides et des cérambycides. Elle était à une époque placée à côté des curculionides, qui sont les véritables charançons, et du fait de cette position taxonomique, maintenant tombée en désuétude, on voit subsister dans un certain nombre de publications le terme impropre de “charançon” dans les noms vernaculaires, ce qui a donné lieu à une équivoque sur les liens de parenté réels de ce groupe. C'est ainsi que l'espèce commune Callosobruchus maculatus F. a été désignée sous le nom de “charançon du dolique austral” (Larson 1927), et que l'espèce voisine C. chinensis L. était encore appelée en 1975 “charançon du haricot” (Doria et Raros 1975).
La famille des bruchidés est divisée en 56 genres, dont 10 se trouvent dans l'ancien monde. La taxonomie des genres de l'ancien monde est restée relativement immuable depuis la description qui en a été faite à la fin du 18ème ou au début du 19ème siècle, où l'on a attribué la plupart des espèces au genre Bruchus. L'addition d'un nouveau genre Bruchidius par Schilsky en 1905, et d'un ou deux autres genres tels que Tuberculobruchus et Conicobruchus, sont les seuls changements intervenus. Le premier et unique cataloguage du groupe fut entrepris par Pic (1913), et depuis cette époque de nombreuses espèces nouvelles ont été décrites. Une tentative de reclassement a été faite par Bridwell en 1946, mais il s'intéressait surtout aux genres du nouveau monde.
L'intérêt porté à la taxonomie de ces insectes s'est accrue grâce aux travaux de Bottimer, Kingsolver et Johnson. Toutes les révisions qui ont été faites dans l'ancien monde concernaient des genres et espèces associés à des plantes d'intérêt économique, plutôt que de constituer des révisions taxonomiques régionales indépendamment de la plante hôte. En conséquence on a créé de grands genres peu pratiques qui sont un ramassis d'espèces sans relations entre elles.
Les bruchidés sont pour la plupart de petits insectes; les plus grands n'excèdent pas 10 mm de longueur, et la majorité des espèces ont de l'ordre de 3 à 4 mm. Ils ont une forme ovale, mais qui paraît légèrement tronquée aux deux extrémités, ce qui est dû à l'habitude qu'a l'insecte de tenir la tête perpendiculaire au reste du corps, ainsi qu'à la position du dernier segment dorso-abdominal scutiforme (pygidium), qui est presque vertical. La plupart des espèces ont de grands yeux composés, avec une fente profonde en “ U ” s'ouvrant vers l'avant. Les antennes partent de cette fente, et chez tous les genres à l'exception de quelques-uns elles sont fines et ont environ la moitié de la longueur totale de l'insecte. Les segments des antennes sont cunéiformes sur la plus grande partie de la longueur (fig. 1). Le thorax des bruchidés a une forme qui va de large avec une seule dent de chaque côté à conique chez Callosobruchus (fig. 2). Les élytres sont presque carrés, à peine plus longs que larges chez la plupart des genres (voir Planche 1). Chez le mâle l'apex terminal est courbé vers l'avant de l'insecte (fig. 3a), tandis que chez la femelle il est droit (fig. 3b). Les pattes portent des griffes bien développées à l'extrémité de tous les tarses. Les fémurs postérieurs sont larges, et même très larges dans certains genres, et armés de piquants sur le bord ventral près de l'apex. Ce dernier caractère est utilisé pour la détermination des différents genres et espèces (voir fig. 4).
Figure 1 Antenne d'un bruchidé typique
La plupart des bruchidés ont une pubescence constituée de poils aplatis en écailles, couvrant le thorax et les élytres et formant des plages de diverses teintes, allant du brun clair au noir, parsemés de petites tâches blanches. Les dessins qu'elles présentent sur les élytres sont caractéristiques de certaines espèces, mais ce n'est pas un caractère de détermination suffisamment précis, et il faut par conséquent faire appel à d'autres caractères.
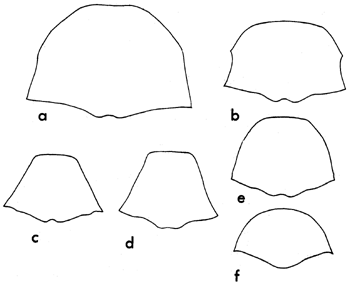
| Figure 2 | Forme générale du thorax chez quelques genres communs debruchidés: | ||
| a) Caryedon | b) Bruchus | c) Bruchidius | |
| d) Callosobruchus | e) Acanthoscelides | f) Spermophagus | |

Figure 3a Profil de l'abdomen d'un bruchidé mâle montrant les différences dans la forme du pygidium
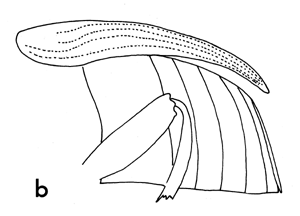
Figure 3b Profil de l'abdomen d'un bruchidé femelle montrant les différences dans la forme du pygidium
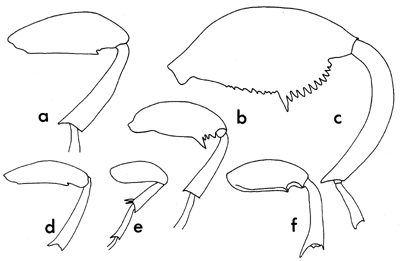
| Figure 4 | Fémur postérieur de quelques genres communs de bruchidés | ||
| a) Bruchus | b) Acanthoscelides | c) Caryedon | |
| d) Bruchidius | e) Spermophagus | f) Callosobruchus | |
Peu d'études ont été faites sur la biologie de la majorité des espèces de bruchidés, en dehors de celles qui sont associées aux légumineuses à graines cultivées, par conséquent on n'a que peu de détails sur leur cycle biologique. Toute tentative sérieuse de lutte contre les bruchidés qui s'attaquent aux légumineuses arborescentes des zones arides se heurte à un manque de données d'observation. Nous avons besoin de connaître, par exemple, l'époque de la ponte sur un hôte donné, le cycle biologique, la gamme d'hôtes au stade adulte, etc. Cette information fait également défaut pour certaines espèces communes économiquement importantes dans les conditions du terrain. On sait par exemple que Callosobruchus maculatus F. accomplit son cycle biologique, de l'oeuf au stade adulte, en 28 jours en conditions de laboratoire à 27°C, 70 % d'humidité relative, mais la durée du cycle en conditions de terrain pour le même insecte n'a jamais été observée avec précision.
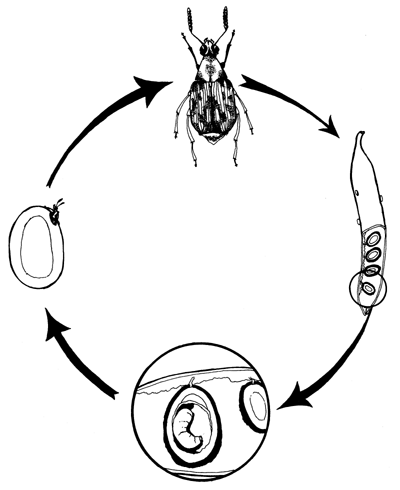
Planche 2 Diagramme du cycle biologique des bruchidés
On peut diviser les bruchidés, bien que d'une manière quelque peu artificielle, en deux groupes. Le premier groupe attaque les graines au moment où les jeunes gousses se forment; les larves, après l'éclosion, pénètrent dans les graines et restent pendant toute la durée de leur évolution dans les graines et les gousses en développement, la sortie des insectes adultes coïncidant avec la maturité des graines ou se situant peu après. Le second groupe peut aussi commencer à infester l'hôte sur le terrain, mais à un stade plus avancé du développement des gousses, c'est-à-dire lorsqu'elles commencent à mûrir et que la croissance des graines est presque terminée. Les adultes de ce groupe sortent peu après la récolte, et continuent de réinfester les mêmes graines; il ne leur est pas indispensable de chercher une gousse arrivant à maturité pour y déposer leur ponte.
Ces deux groupes se distinguent en partie par la spécificité de l'hôte, les insectes du second groupe étant associés à des cultures herbacées basses de la famille des fabacées telles que dolique (cowpea), haricot doré (mung bean), etc. tandis que la majorité des espèces du premier groupe sont associées à des arbres et arbustres appartenant aux césalpiniacées et aux mimosacées.
Les oeufs de bruchidés sont de deux types: cylindrique et hémiovoïde. Dans le premier type, la larve sort par une extrémité de l'oeuf, et chemine à la surface de la gousse avant de prénétrer par une fissure convenable. Dans le second l'oeuf est solidement fixé au substrat par une sécrétion qui le recouvre et s'étend en un bourrelet qui scelle l'oeuf sur le substrat. Cette sécrétion a une double fonction: elle protège l'oeuf de la dessiccation, et lui assure une fixation solide sur l'hôte; enfin, ce qui est le plus important, elle aide la larve à pénétrer dans la gousse en lui fournissant un point d'appui pour percer une voie d'entrée à l'aide de ses mandibules.
La majorité des espèces de bruchidés s'attaquant aux acacias, qui intéressent le présent projet, pondent des oeufs du premier type sur la surface des gousses en développement. Le point de ponte le plus fréquent est la suture de la gousse, mais sur certaines espèces d'acacias, notamment celles qui ont des gousses lomentacées, les oeufs sont habituellement déposés dans les étranglements situés entre les graines, ce qui peut assurer à l'oeuf un peu plus de protection que s'il était déposé à un emplacement plus exposé sur la gousse. La plupart des bruchidés, dans la nature, pondent des oeufs isolés, à intervalles largement espacés. Une ou deux espèces ont un mode de ponte multiple, dans lequel des groupes de 6 à 8 oeufs de forme hémiovoïde sont déposés de telle sorte qu'un tiers ou plus de la surface inférieure d'un oeuf recouvre l'oeuf situé immédiatement en dessous. Ce fait a été observé et illustré pour la première fois par Teran (1962) pour l'espèce sud-américaine Pseudopachymerina spinnipes (Erich.), bruchidé introduit et maintenant largement répandu dans certains pays de la région méditerranéenne, du Moyen Orient et de l'Afrique, sur ses deux hôtes Acacia farnesiana et A. caven. Ce mode de ponte en masse présente l'avantage, comme l'a souligné Prevett (1967), que seuls les oeufs des couches supérieures sont exposés aux attaques de parasites, ou autres causes de destruction.
Tandis que la majorité des espèces de bruchidés pondent sur de jeunes gousses en cours de développement, un petit nombre d'espèces choisissent sur les arbres les gousses arrivées à maturité. L'emplacement choisi par la femelle est habituellement la ligne de déhiscence le long de la suture.
En règle générale le développement de l'oeuf dure de 5 à 10 jours à partir du moment de la ponte. La première nécessité pour la larve à l'éclosion est d'accéder à la graine. Pour les larves qui pénétrent d'abord à travers la paroi de la gousse, ensuite à l'intérieur de la graine, c'est une aventure qui peut prendre plusieurs heures.
On mentionne dans la littérature que les larves ingèrent les matériaux enlevés pour pénétrer dans la graine et accéder aux cotylédons. L'enveloppe de certaines graines de légumineuses contient des toxines, et on a attribué le fait que des larves ne survivent pas après l'avoir pénétrée à l'ingestion de substance toxiques. On en a conclu que la toxicité de l'enveloppe de la graine constitue pour celle-ci une barrière de protection efficace.
On a démontré récemment (Southgate 1983) que les larves de Callosobruchus sp. n'ingèrent pas les matériaux enlevés pour pénétrer l'enveloppe de la graine, mais les râpent et les poussent de côté sans les faire passer par leur tube digestif. Bien que ces observations ne portent que sur un seul genre, il n'y a pas de raison de penser qu'elles ne s'appliqueraient pas de même à toutes les espèces de bruchidés.
Les larves de bruchidés creusent tout d'abord une galerie à l'intérieur de la graine, et ensuite l'élargissent en une loge. Durant leur période de croissance, qui peut durer de 3 à 4 semaines à plusieurs mois, selon les conditions climatiques, les larves muent 4 fois, et ensuite se transforment en nymphes. Auparavant elles préparent la sortie des adultes: la paroi de la loge située vers l'extérieur est dégagée et élargie, ne laissant qu'une mince couche de tégument qui forme une fenêtre circulaire translucide. Pour sortir, les adultes percent cette paroi avec leur mandibules, en laissant un trou circulaire.
Chez un genre au moins de bruchidés de l'ancien monde les larves abandonnent la graine lorsqu'elles ont atteint leur plein développement, et forment leur nymphe dans un cocon papyracé situé à l'intérieur de la gousse ou fixé à l'extérieur. Une espèce de Caryedon d'Afrique australe a des larves qui pénètrent dans le sol pour y faire leur nymphe (Skaife 1926). Le temps passé dans la cellule nymphale ou le cocon est variable. Tandis que la plus grande proportion des adultes sortent dès qu'ils sont complètement développés, d'autres, comme Caryedon serratus ssp. palaestinicus (Southgate), peuvent rester plusieurs mois dans la cellule ou le cocon (Donahaye, Navarro et Calderon 1966). Cette diapause de l'insecte adulte a pour fonction de perpétuer l'espèce jusqu' à la saison suivante où de nouvelles gousses seront disponibles.
On ne dispose que de peu d'observations sur la dispersion et le vol des bruchidés adultes, même pour les espèces qui s'attaquent aux plantes cultivées. Mathwig (1971), étudiant des bruchidés associés à Gleditsia sp. au Texas, découvrit que les vols de ponte avaient lieu pendant la nuit. Cela peut s'appliquer à cette espèce particulière, mais n'est pas vrai pour toutes les espèces. Le seuil de température au-dessus duquel les bruchidés deviennent suffisamment actifs pour voler se situe normalement à 25°C. Dans les zones semi-arides, à végétation clairsemée, les températures nocturnes descendent bien au-dessous de ce chiffre. Il faudrait davantage de recherches sur cet aspect du vol et sur les habitudes alimentaires des adultes. Par analogie avec les constatations faites au cours d'expériences de laboratoire, on peut penser qu'il n'est pas indispensable pour les insectes adultes de se nourrir. Les adultes sont attirés par les fleurs d'acacias et espèces voisines ainsi que par les nectaires extra-floraux, et leur rassemblement en ces points rapproche les sexes et favorise l'accouplement. Il est possible aussi que le stimulus alimentaire déclenche la sécrétion de phérormones sexuelles. L'absorption de pollen ou de nectar n'est pas indispensable pour la maturation des ovaires, mais accroît sans aucun doute la fécondité, et prolonge peut-être la vie de l'insecte.