By Mr. PELLIER (France)
I. LES BASES REGLEMENTAIRES
Le contrôle sanitaire des coquillages a été instauré dés 1913, à l'instigation de groupements professionnels. Le contrôle de la production et de la commercialisation des huîtres est pris en charge par l'Administration en 1923, il est étendu à tous les coquillages (bivalves filtreurs, gastéropodes, oursins et violets) en 1939.
Le décret du 20 août 1939, actuellement en vigueur, reste le texte de base de la règlementation sanitaire française jusqu'à la traduction en Droit français de la Directive Européenne 91/492 CEE du 15 juillet 1991.
Aujourd'hui plusieurs services aministratifs participent aux opérations de contrôles; ce sont:
Les Directions départementales des Affaires Maritimes, dépendant du Ministère chargé de la Mer. Pour mener cette tâche, cette administration bénéficie du concours scientifique et technique de l'Institut Français de Recherche pour l'Exploitation de la Mer (IFREMER), notamment des services rattachés à la Direction de l'Environnement et de l'Aménagement Littoral.
Les Directions départementales des Affaires Sanitaires et Sociales, relevant du Ministère de la Santé.
Les Directions départementales des services vetérinaires, relevant du Ministère de l'Agriculture.
Le contrôle recouvre l'ensemble de la chaîne, depuis:
- le milieu marin, avec la surveillance des gisements naturels et des zones d'élevage (Affaires Maritimes, Ifremer, Santé);
- les établissements à terre où les produits sont manipulés et conditionnés en vu de la mise en marché (Affaires Maritimes, Ifremer, Vétérinaires);
- jusqu'au circuit de commercialisation (Vétérinaires).
II. LA SENSIBILITE PARTICULIERS DES COQUILLAGES A LA CONTAMINATION
Les coquillages bivalves sont des denrées alimentaires particulièrement sensibles à la contamination. Ce sont en effet des organismes filtreurs qui, pour la plupart d'entre eux, vivent naturellement sur la frange littorale et par ailleurs sont souvent consommés crus.
A) La capacité de filtration
Les bivalves sont des organismes planctonophages qui par filtration retiennent les fines particules en suspension dans l'eau, préférentiellement celles dont la taille est inférieure à 20 u.
Ils concentrent dans l'hépatopancréas et la tube digestif le nanoplancton mais aussi les bactéries libres ou absorbées sur la matière organique, les virus et les micropolluants chimiques éventuellement présents dans l'eau de mer (cf tableau annexe II ci-joint, rapportant les volumes d'eau filtrée selon walne).
La qualité des eaux dans lesquelles vivent les coquillages va donc influer directement sur leur qualité sanitaire.
Cette faculté d'intégrer certaines pollutions sera d'ailleurs exploitée par les environnementalistes pour la surveillance de la qualité des eaux marines. Il convient toutefois de savoir que le pouvoir concentrateur varie d'une espèce à l'autre et d'un polluant à l'autre.
B) La localisation des zones de culture ou de pêche
La plupart des espèces sont cultuvées ou vivent naturellement sur la zone littorale parfois soumise à des apports polluants:
- soit directs, tels que les canalisations d'évacuation d'eaux usées urbaines ou d'effluents industriels;
- soit indirects, par lessivage des sols après épandage d'engrais, de lisiers ou de pesticides.
C'est ainsi que de nombreuses bactéries ou virus pourront se retrouver dans les eaux conchylicoles et contaminer les coquillages. Le Tableau en annexe III relate une dizaine de bactéries susceptibles de provoque des troubles infectieux chez les consommateurs de coquillages, d'apès HUSS, et que l'on a pu rencontrer dans le milieu marin.
Ces bactéries peuvent schématiquement être classées en deux groupes:
- celles qui dans le milieu marin ne trouvent pas de conditions favorables à leur développement telles que Esherichia Coli et Salmonelles;
- celles qui s'accommodent facilement de la présence de sel dans l'eau de mer comme c'est le cas des Vibrio
Enfin, les coquillages font partie des denrées alimentaires souvent consommées crues, viscères compris, sans la moindre cuisson susceptible d'offrir une bonne protection contre le risque bactérien.
En France, enviorn 150 000 tonnes de coquillages sont consommées vivants, soit environ les 2–3 du tonnage mis sur le marché.
III- LA QUALITE SANITAIRE DES COQUILLAGES
Pour réduire le risque sanitaire lié à la consommation des coquillages, la France a mis en place des mesures règlementaires permettant d'apporter un maximum de garanties quant à la qualité sanitaire des produits mis en marché.
Elle a, en particulier, fait porter ses efforts sur la qualité sanitaire des zones d'élevage avec le souci constant de produire des coquillages salubres pour éviter d'avoir à leur faire subir un traitement de purification avant commercialisation.
A) Le classement des zones littorales
Le littoral est classé en zone salubre et zone insalubre en fonction de la qualité des eaux qui le baignent.
La qualité de l'eau est déterminée à travers la contamination bactériologique des coquillages qui vivent dans la zone. Les coquillages peuvent être introduits intentionnellement s'ils ne sont pas naturellement présents dans cet endroit.
La contamination est déterminée par le nombre le plus probable de coliformes fécaux contenus dans 100 ml de broyat de chair de coquillages et de liquides intervalvaires.
La règlementation a prévu que les prélèvements doivent être échelonnés sur un an, à raison de 26 par an. (cf tableau annexe IV, classement des zones)
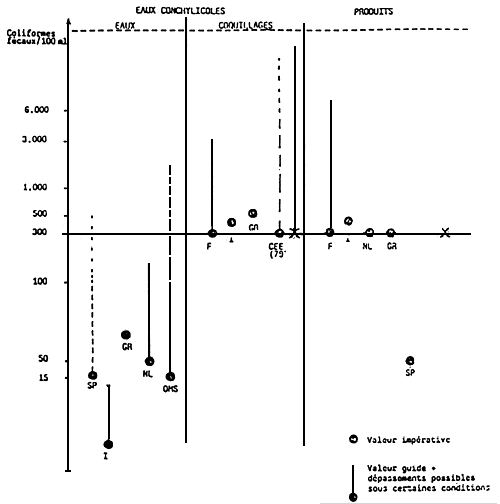
Toute zone dans laquelle il ne sera pas mis en évidence plus de 300 coliformes fécaux dans 100 ml sera classée salubre.
Toutefois, pour tenir compte de la variabilité naturelle du milieu, il sera admis des dépassement à cette valeur pour cinq échantillons au maximum; dans ce cas, trois résultats peuvent être compris entre 300et 1000, 2 résultats entre 1000 et 3000, aucun ne doit dépasser 3000.
Si ces normes sont dépassées, la zone est classée insalubre. L'élevage des coquillages de taille marchande y sera interdit. Seules les opérations de captage de naissains pourront y être autorisées.
Il n'est pas rare de rencontrer des populations naturelles de coquillage dans des zones classées insalubres. Les opérations de pêche y sont strictement règlementées par l'Administration des Affaires Maritimes. Les produits de taille marchande doivent être purifiés avant livraison à la consommation, soit par traitement en station de purification spécialement aménégée à cet effet, soit par reparcage de longue durée en zone salubre.
Toutefois, si 25% des échantillons contient plus de 10 000 coliformes fécaux/100 ml, le reparcage est conditionné à l'avis complémentaire des représentants locaux du Ministère de la Santé.
B) L'autorisation de commercialisation des produits.
Sont seuls autorisés à commercialiser des coquillages les professionnels disposant d'installations permettant de conserver et de manipuler les produits dans de bonnes conditions d'hygiène. L'agrément est délivré par l'Administration des Affaires Maritimes après consultation et avis des services vétérinaires et de l'IFREMER.
L'établissement type d'expédition d'huîtres dispose :
- d'une prise d'eau fixe à la mer,
- un ou plusieurs bassins alimentés en eau de mer propre pour le dégorgement des coquillages,
- un dispositif pour le lavage extérieur des coquilles,
- un atelier pour le conditionnement des produits.
L'établissement doit avoir accès à des installations sanitaires individuelles ou collectives sans rejet en milieu naturel.
Suivant son volume de production, il pourra aussi posséder des réserves d'eau de mer, une réserve ou dépôt à coquillages, un emplacement pour le dépôt des déchets de triage.
A la sortie de, l'établissement, le contrôle de la qualité des produits relève des services vétérinaires. Il en est de même pour l'agrément des véhicules de transport, le contrôle des points de vente en gros ou au détail.
Chaque colis est identifié par une marque sanitaire apposée sous la responsabilité de l'expéditeur. Elle doit indiquer :
- le pays expéditeur des coquillages,
- l'espèce concercée,
- le numéro d'agrément de l'étalissement,
- la date du conditionnement.
Actuellement, la qualité sanitaire des produits mis en marché relève de l'arrêté du 21 décembre 1979. (cf tableau annexe № IV)
La contamination bactérienne doit être inférieure à 300 coliformes fécaux/100 ml. Toutefois, sont considérés comme acceptables certains dépassements jusqu'à 3 000 avec tolérance de 2 sur 5 entre 3 000 et 5 000 coliformes fécaux/100 ml.
Par ailleurs, lorsqu'il existe une suspicion particulière sur la qualité du produit, les streptocques fécaux sont dénombrés. 100 ml de chair de coquillage ne doivent pas en contenir plus de 2 500.
Enfin, il ne doit pas être mis en évidence de salmonelle dans 25 g de chair.
Evolution dans le cadre de la mise en application de la Directive Européenne du 15 juillet dernier
- Zones d'élevage et de pêche
Chaque état membre va devoir désigner ses eaux conchylicoles selon la contamination bactérienne des coquillages qui y vivent. (cf tableau annexe VI)
- Les zones de catégorie “A” :
Il s'agira de zones dans lesquelles la contamination bactérienne sera toujours inférieure à 300 coliformes fécaux/100 ml sans tolérance de dépassement comme le permet aujourd'hui la règlementation française.
- Les zones de catégorie “B” :
Dans cette catégorie, la contamination bactérienne des coquillages peut aller jusqu'à 6 000 coliformes fécaux/100 ml. L'exploitation de la zone est autorisée, les coquillages ne peuvent être mis en marché qu'après avoir subi une purification. Cette opération peut se réaliser soit par reparcage dans la zone précédente, soit par traitement dans un établissement de purification.
- Les zones de catégorie “C”:
La contamination des coquillages peut dans cette zone atteindre des valeurs comprises entre 6 000 et 60 000 coliformes fécaux. Les produits ne peuvent être livrés à la consommation qu'après reparcage de longue durée (2 mois) dans la zone de catégorie “A”.
- La dernière catégorie regroupe les zones interdites à toutes opération de pêche ou d'élevage. Aucun des traitements définis ci-dessus ne pouvant apporter de garantie quant à la qualité finale des produits.
• Produits mis en marché
La réglementation européenne prévoit que :
- la contamination bactérienne ne devra pas dépasser 300 coliformes fécaux/100 ml, sans tolérance de dépassement;
- l'absence de salmonelle dans 25 g de chair de mollusque;
- il ne devrait pas contenir de produit toxique ou nocif tels que les micropolluants chimiques définis dans la Direction Européenne de 1979;
- le taux de P.S.P. (Paralytic shellfish Poison) ne doit pas dépasser 80 ug/100 g;
- L'analyse biologique habituelle ne doit pas donner de réaction positive en ce qui concerne la présence de D.S.P. (Diarrhetic Shellfish Poison).
IV - LES RESEAUX DE SURVEILLANCE
On a vu que la qualité sanitaire des coquillages mis en marché dépendait directement de la qualité des eaux dans lesquelles ils vivent. Aussi, l'IFREMER a, depuis quelques années, mis en place trois réseaux de surveillance de la qualité des eaux littorales.
1) Le plus ancien, le Réseau National d'Observation de la qualité du milieu marin (R.N.O.), date de 1974 pour les observations sur l'eau et de 1978 pour la matière vivante et les sédiments.
Il correspond à l'application la France des conventions internationales de Londres en 1972 sur l'immersion des déchets en Mer du Nord et Atlantique Nord-Est, de Paris en 1974 sur les pollutions d'origines telluriques et de Barcelone en 1976 pour la prévention des pollutions en Méditerranée. C'est l'objectif environnemental “niveau et tendance” qui a, dans un premier temps, motivé la mise en place du R.N.O.
2) Plus récemment en 1983, l'IFREMER mettait en place sur l'ensemble des zones conchylicoles françaises un réseau de surveillance phytoplanctonique (REPHY). Ce réseau faisait suite à un développement très important d'une espèce phytoplanctonique toxique - le dinophysis - sur les côtes bretonnes, entraînant plusieurs milliers de gastro-entérites chez les consommateurs de moules.
Sa vocation première est la protection de la santé publique.
3) Enfin, un réseau de surveillance microbiologique a été développé en 1989. Outre l'aspect environnemental (évolution des niveaux et tendances) il conserve l'objectif initial de protection de la santé publique
A) Le R.N.O.
Il s'intéresse aux paramétres généraux de la qualité des eaux sur onze sites (températures, salinité, sels nutritifs, oxygène dissous, chlorophylles et phaeopigments).
Le rythme de surveillance est de deux à cinq campagnes par an en Manche, Atlantique, 6 à 12 en Méditerranée.
Pour ce qui concerne les micropolluants, la suveillance porte prioritairement sur la matière vivante, huîtres et moules essentiellement.
Le réseau comprend 43 sites répartis le long du littoral (cf annexe VII).
Les paramètres systématiquement mesurés sont les suivants:
- Parmi les métaux lourds, le Hg, Pb, Cd, Cu et Zn;
- les composés organochlorés: DDT, DDD, DDF, HCH, Lindane et Polychlorobiphenyls (PCB);
- les hydrocarbures polyaromatiques.
Les stations sont échantillonnées quatre fois par an. L'ensemble des laboratoires côtiers de l'IFREMER (11 unités) intervient dans la phase prélèvement. Les analyses sont regroupées dans un laboratorie unique à NANTES.
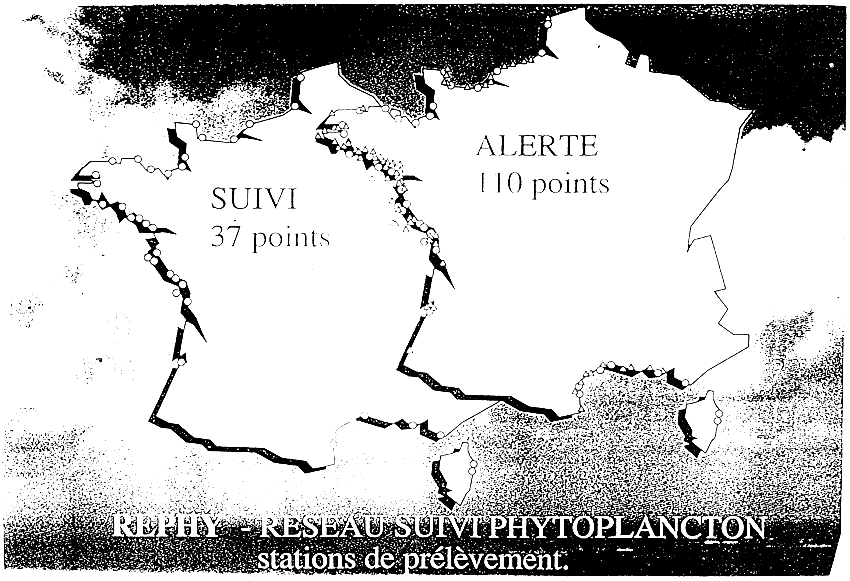
B) LE REPHY
Ce réseau qui concerne actuellement 38 sites (cf annexe VIII) est largement décentralisé. Prélèvements et analyses sont réalisés dans les 11 laboratoires de l'IFREMER.
Le dénombrement total des espèces phytoplanctoniques est effectué au microscope inversé par lecture en cuve à décantation de 10 cm3.
Le système fonctionne à deux niveaux:
- niveau “suivi” en l'absence de phénomène particulier, avec prélèvement par quinzaine en période hivernale et un par semaine en période à risque, de mai à septembre;
- un niveau “alerte” dès que des espèces toxiques apparaissent ou en présence d'eaux colorées.
Le passage au niveau “alerte” entraîne une multiplication des points de prélèvements et une augmentation de leur rythme qui peut devenir bi-hebdomadaire.
Les tests de toxicité sont effectués sur des souris à partir des hépatopancrèas des coquillages suspects. Les divers services concernés par la mise en place des mesures règlementaires sont tenus informés des résultats des examens.
Au cours des dernières annés, “Dinophysis”, phytoplanctonique produisant une toxine de type D.S.P., a été mis en évidence sur plusieurs secteurs du littoral français (Normandie, Sud-Bretagne, charente-Maritime et Méditerranée notamment).
“Alexandrium minutum”, produisant une toxine de type P.S.P. n'a été qu'en Bretagne-Nord dans les Abers.
C) LE REMI
Ce réseau de surveillance est, comme le précédent, totalement décentralisé. Prélèvements et analyses sont réalisés par les agents en place dans les 11 laboratoires côtiers d'IFREMER.
Près d'une centaine de sites, répartis sur l'ensemble du littoral, font l'objet de prélèvements mensuels (annexeIX).
La qualité bactériologique de la zone est mesurée à partir du nombre le plus probable de coliformes fécaux mesurés dans 100 ml de chair de mollusques et la présence ou l'absence de salmonelles dans 25 g de chair de coquillages.
L'effort d'échantillonnage est proportionnel à un indice du risque qui tient compte à la fois du volume de production coquiller dans le site et du niveau de salubrité de la zone.
Comme le réseau phytoplanctonique, il fonctionne à un niveau “alerte” dès que l'on a connaissance d'une augmentation du risque Santé Publique.
Cette phase “alerte”peut être lancée:
- soit par un résultat défavorable du réseau de surveillance;
- soit par des conditions particulières, météo défavorable (pluies, tempêtes), épandages de lisier en zone littorale, des rejets accidentels d'eaux usées….
Les premiers résultats acquis confirment la salubrité des principales zones de production ostréicole. Pour ce qui concerne la mytilicuture, les résultats sont plus nuancés.
Chacun des ces réseaux fait l'objet d'une coordination centrale. Tous trois bénéficient d'une gestion des données informatisés.
En particulier, les données acquises par les réseaux phytoplanctoniques et microbiologiques font l'objet d'une saisie en temps réel sur une banque de donnée immédiatement accessible par les partenaires extérieurs (Administration des Affaires Maritimes et Services Vétérinaires).
II n'en reste pas moins vrai que ces réseaux sont lourds à gérer en raison notamment des contraintes de déplacements sur le terrain pour les prélèvements.
Développements nouveaux et perspectives
Depuis quelques années l'IFREMER travaille à la mise en place d'un réseau réseau instrumenté pour la surveillance de l'environnement littoral.
Le système entièrement automatisé comprendra:
- des capteurs multi-paramètres sur bouées;
- une transmission des données par satellite;
- leur réception, archivage, traitement et validation par des stations à terre;
- leur mise à disposition par réseaux informatisés.
Les paramètres hydrologiques pris en compte seront la température, la salinité, la conductivité, le pH, l'oxygène et les sulfures ultérieurement l'éclairement et la turbidité.
Ce réseau, dont la première station automatisée sera mise en place en 1993 est connu sous le nom de RAVEL (Réseau Automatisé de Veille pour l'Environnement Littoral).
ANNEXE I: Les services administratifs concernés par les contrôles sanitaires des coquillages.
| Service Administratif concerné | Ministère de rattachement | Secteur d'intervention |
| Direction Départementale des Affaires Maritimes avec concours IFREMER | Ministère chargé de la mer | • gisement naturel |
| • zones d'élevage | ||
| • établissements d'expédition | ||
| Direction Départementale des Affaires Sanitaires et sociales | Ministère de Santé | • gisements naturels (essentiellement pêche récréative) |
| Direction Départementale des Services Vétérinaires | Ministère de l'agriculture | • établissements d'expédition |
• mise en marché des produits (transport, pointsde vente…) |
ANNEXE II : Taux de filtration, en 1/h. de 0.edulis, C. gigas et M. edulis à 20–21° C, selon WALNE
| TAILLE (en mm) | OSTREA EDULIS | CRASSOSTREA GIGAS | MYTILLUS EDULIS |
| 40 | 4,14 | 5,76 | 2,46 |
| 50 | 5,16 | 6,30 | 3,18 |
| 60 | 6,18 | 6,84 | 3,84 |
| 70 | 7,32 | 7,20 | 4,56 |
ANNEXE III : Caracteristiques des principales bacteries pathogenes
| BACTERIES | HABITAT HABITUEL | Dose minimale infectante D.M.I. | Température minimale de croissance °C | ||
| Eau | Hommes | Environnement | |||
| E. coli enterotoxique | * | 104 à 1010 | 15 | ||
| Salmonella | * | 102 à 105 | 5 | ||
| Vibrio | * | 105 à 107 | 8 | ||
| parahaemoliticus | * | ||||
| Vibrio cholerae 01 | * | * | 106 à 109 | ||
| Vibrio cholerae | * | * | 106 à 109 | ||
| non 01 | |||||
| Vibrio vulnificus | * | * | environ 8 | ||
| Shigelles | * | 101 à 102 | |||
| Staphylocoques | * | 10 | |||
| Aeromonas | * | * | 0 | ||
| C. perfingens | * | 15 | |||
| C. botulinum | * | * | 3,2 | ||
NORMAES DE SALUBRITE DES ZONES CONCHYLICOLES
(arrêté du 12 octobre 1976)
| Classement | C. Fecaux/100 ml | Observations | |
|---|---|---|---|
| Zone salubre | < 300 | Tolérance de dépassement: | |
| 3/26 par an < 1 000 | |||
| 2/26 par an < 3 000 | |||
| Zone insalubre | 300 < | <10 000 | Consultation DDASS obligatoire, si 25% > 10 000 |
| CF/100 ml de chair de coquillages | |||||
| MILIEU | PRODUITS | ||||
| ARRÉté au 12/10/1976 | Arrété du 21/12/1979 | ||||
| Fréquence | Fréquence acceptable par classe | Produits reéputés dangereux | |||
| 300 000 | 103m | ||||
| Produits qualité non satisfaisante | |||||
| 9 000 | 30 m | ||||
| Qualité acceptable si moins 3/5 résultats compris entre 10 m et 30 m | |||||
| Résultat non acceptable | Qualité non satisfaisante si plus 3/5 résultats compris entre 10 m et 30 m | ||||
| 0% | 3 000 | 10 m | |||
| 8% | 8% | Résultat très suspect | |||
| 1 000 | |||||
| 19 | 11% | Résultat | Résultat satisfaisant | ||
| 300 | |||||
| 100 | 81% | Résultat acceptable ou satisfaisant | m• | ||
| 0 | |||||
m• : valeur guide fixée à 300 dans arrêté du 21/12/1979
Normes de salubrité des coquillages (d'après Poggi, 1986)
Normes de salubrité en vigueur dans certains pays de la C.E.E et proposées par la Commission des Communautés Européennes.
Le classement des zones
(élevage ou pêche)
| Degré de contamination bactérienne | Possibilité d'élevage ou de pêche | Conditions de mise un marché des produits |
| < 300 C.F./100 ml | Autorisée | Conditionneement en centre d'expédition agrée. |
| de 300 à 6 000 C.F./100 ml | Autorisée avec clause | soit pur reparcage purification |
| conditionnelle | soit par traitement en ets de purification agrée | |
| de 6 000 à 60 000 C.F./100 ml | Autorisée avec clause conditionnelle | Reparcage de 2 mois obligatoire avant mise en marché |
| > à 60 000 C.F/100 ml | Interdite | Interdit |
RESEAU NATIONAL D'OBSERVATION
DE LA QUALITE DU MILIEU MARIN
DISPOSITION DES SITES DE
SURVEILLANCE
Réseau de surveillance microbiologique
Stations de suivi.
by Mr. VALLET (France)
L'aquaculture marine est devenue une réalité pour plusieurs espèces avec une orientation forte vers le marché du frais.
Cependant cette production constitue également une matière première potentielle pour le filière de valorisation alimentaire.
Cette démarche d'ouverture vers la transformation, pour être positive, devra prendre en compte un certain nombre de facteurs spécifiques à l'industrie alimentaire.
Dans cette optique l'aquaculture marine dispose d'atouts intéressants, qu'elle devra valoriser.
Après un bref rappel des technologies mises en oeuvre en matière de valorisation ainsi que de l'adaptation de ces procédés à l'évolution de la consommation française des produits marins transformés, il sera étudié, dans ce contexte, les atouts de l'aquaculture face à l'activité de pêche.
La seconde partie sera consacrée à la présentation de quelques exemples de valorisation ayant pris en compte cette nouvelle réalité de l'aquaculture marine, et à un état des travaux de recherche menés à l'IFREMER sur ce thème, en liaison avec d'autres organismes scientifiques.
I-Technologie mise en oeuvre dans la transformation des produits marins
I-1-Procédés traditionnels
• SAURISSAGE: dans cette catégorie sont considéres les procédés faisant intervenir un ou plusieurs agents conservateurs participants au processus de transformation.
- Produits salés (anchois), salés (morue) fumés à froid (saumon), fumés à chaud (sardine), marinés (hareng).
• TRAITEMENTS THERMIQUES: les procédés sont déterminés d'une part en liaison avec l'intensité du traitement pouvant aller de la simple cuisson jusqu'à l'appertisation, mais également en liaison avec le mode de conditionnement.
A titre d'exemple, dans cette catégorie les plats cuisinés pasteuriseés sont en pleine expansion avec notamment les produits cuits sous vide.
Dans la majorité des cas, la nature des produits marins mis en oeuvre participe à l'appellation du produit et en constitue l'élément valorisant.
I.2- Procédés de retexturation
Le meilleur exemple de ces nouveaux procédés est donnés par le surimi. Le principe est de fabriquer à partir d'une chair de poisson ayant les caractéristiques adéquates, une nouvelle matière première riche en protéines, possédant des propriétés fonctionnelles originales; en particulier une bonne aptitude à la gélification. Ce surimi permet alors d'élaborer des produits retexturés du type succédané arômatisé au crabe.
Dans cette démarche, le poisson ayant servi de matière a totalement perdu son identité. Cela ne concerne donc, à priori que des espèces de faible valeur mais ayant une disponibilité importante.
II- Evolution de la consommation des produits marins en France
Actuellement la demande du consommateur et l'image marketing données aux produits marins ont eu pour conséquence de faire émerger de nouvelles catégories de produits alimentaires ayant pour référence:
- le caractère “frais” concernant à la fois la matière premièer mise en oeuvre mais également le produit fini,
- une demande de produit ayant un dègré d'élaboration élévé et ne nécessitant qu'un mimimum de préparation pour le consommateur, se limitant fréquemment à un simple réchauffage,
- l'aspect diététique notamment le caractère allègé, mais également le respect des valeurs nutritionnelles avec un volet important accordé aux lipides,
- l'aspect sensoriel faisant référence à des préparations à connotation gastronomique.
Cette évolutions a des conséquences importantes sur les filières de transformation et de conditionnement des produits marins.
Ainsi, afin de conserver les qualités nutritionnelles et organoleptiques, les traitements de conservation ont été diminués, ce qui a été rendu possible par la maîtrise de la chaîne du froid.
A titre d'exemple, dans le process du saumon fumés, intensités du salage, du séchage et du fumage ont été fortement diminuées et répondent pour l'essentiel à des critères organoleptiques.
La même tendance se retrouve pour les traitements thermiques avec une stagnation de la conserve de plats cuisinés et un développement des produits pasteurisés à faible durée de conservations, avec l'émergence d'une nouvelle technique dite de la “cuisson sous vide”. Les arguments sont également d'ordre, diététique et sensoriel.
III- Les atouts de l'aquaculture
Les entreprises qui transforment les produits marins ont schématiquement à leur disposition deux sources d'approvisionnement. D'une part la production de la pêche (frais ou congelé) et d'autre part les matières d'origines aquacoles.
III 1- La pêche
Un des avantages de la pêche est de proposer aux utilisateurs une très grande diversité d'espèces. Par ailleurs, elle permet l'accès à des espèces en stock important, à faible coût permettant d'envisager des transformations de type pulpe ou surimi.
En revanche un certain nombre de contraintes sont liées à ce type d'approvisionnement en matière première.
On peut citer:
- accès plus ou moins difficile à la ressource,
- approvisionnement irrégulier,
- marché fluctuant.
- et une très grande variabilité de la qualité, qui est la conséquence des techniques de pêche,
de stockage et de distribution.
La notion de cycle biologique intervient également fortement sur cet aspect qualité.
III 2- L'aquaculture
En terme d'approvisionnement industriel, les principaux atouts de l'aquaculture sont ou devraient être:
- l'adaptation et la maitrise des paramètres de production en cohérence avec l'usage industriel potentiel du produit obtenu (ex: facteur de composition, de confromation etc…),
- la disponibilité régulière,
- la filière courte de distribution permettant des niveaux de qualité élevés.
Des facteurs moins favorables sont également à prendre en compte:
- image de marque pouvant être pénalisante dans la filière “frais” pour certaines espèces,
- production aquacole d'un nombre d'espèces limité généralement représentées par des productions à forte valeur marchande pouvant créer une situation concurrentielle au détriment de la filière transformation par rapport à la vente en frais.
Ceci a pour conséquence de destiner cette matère première à l'élaboration de produits tranformés “haut de gamme” type plats cuisinés à forte valeur ajoutée, justifiée par l'identité de l'espèce mise en oeuvre (ex.: bar, turbot).
IV- Exemple de valorisation industrielle et travaux de recherche en cours
IV.1- Valorisation industrielle
La production aquacole de salmonidés est un exc3ellent exemple où développement intensif de la production a permis une évolution du shéma industriel de fabrication du saumon fumé.
II y a quelques années, l'essentiel de la production de saumon fumé se faisait sur la base de produits congelés (90%) issus de la pêche avec une prédominance du saumon du pacifique.
La production faite à partir de saumon atlantique ne concernait que la production de très haut de
gamme.
Le développement intensif de la production aquacole du saumon de l'Allantique en Europe du Nord
a en quelques années totalement modifié la physionomie de ce secteur de transformation, ou certaines
usines ont fait le choix de ne travailler que de la matièr première fraîche et ont organisé ou
conçu leur outil de production sur cette base (ex.: Société LABEYRIE).
Cependant, sur ce créneau, où la négociation des prix est extrémement serrée, il est, malgré tout possible de se démarquer en valorisant l'aspect qualité comme a pu le faire la socié té SALMOR par des processus d'élevages originaux.
Si la filière salmonidé est intéressante, car c'est celle sur laquelle il y a le plus d'expérience en matière
de transformation, d'autres espèces aquacoles ont également fait l'objet en France, d'essais de
valorisation intéressants.
Ainsi les huîtres ont étéutilisées dans la préparation de soupes et de plats cuisinés et ont également
été fumées et présentées en conserves à l'huile.
IV. 2- Travaux de recherche concernant la valorisation
Un certain nombre de travaux de recherche sur le thème de la valorisation de la production aquacole sont actuellement en cours à l'IFREMER en collabration étroite avec d'autres organismes scientifiques:
- sur le thème “algue” sont actuellement à l'étude de nouvelles procédures de séchage pour les algues à usage alimentaire et qui sont pour l'essentiel issues d l'aquaculture.
- concernant les truites, un programme de recherche sur financement Aliment 2002 du Ministère de la Recherche et de la Technologie français est en cours sur le thème de l'influence des facteurs génétiques sur la qualité et l'aptitude de la transformation de la truite fario élevée en mer.
Ce programme est en développement en collaboration avec l'INRA (Institut National de Recherche Agronomique) et la société ELSAMER.
• Deux dossiers ont également été initiés, sur le bar et le turbot.
BAR : étude sur la caractérisation du bar d'aquaculture et son positionnement par rapport au bar de pêche, en partenariat avec la société SEPIA et FRANCE-AQUACULTURE.
TURBOT : caractérisation du produit “turbot d'origine aquacole” et effet de l'alimentation sur la qualité.
Ce programme a fait l'objet d'une demande de financement auprès de la CEE.
CREVETTES : les travaux portent sur l'amélioration des procédures de prévention de la mélanose ainsi que sur la substitution du métabisulfite de sodium comme agent de traitement par d'autre produits moins sensibles.
CONCLUSION
L'aquaculture se positionne comme une source alternative de produits marins. Elle concerne actuellement, pour l'essentiel, des produits à forte valeur ajoutée ce qui a pour conséquence de créer une situation concurrentielle entre le marché du frais et l'approvisionnement des entreprises de transformation. Ces dernières sont en effet limitées par des contraintes de prix et de coût de transformation. Si de nouvelles voies de valorisation n'ont pas été spécifiquement mises en oeuvre pour l'aquaculture, celle-ci dispose néanmoins d'atouts importants pour l'avenir notamment ceux concernant:
- la qualité et la fraîcheur,
- l'adaptation du produit à la demande,
- la disponibilité.
L'approvisionnement par la filière aquacole marine, de circuits de valorisation industrielle doit donc relever d'une stratégie cohérente tant sur le plan économique que technique.
Il serait à mon sens fâcheux que cette ouverture vers les circuits de transformation ne se traduise que par des opportunités conjoncturelles liées à une saturation du marché du frais.
By Mr. J. DEBEVERE, Presented by Mr. BELKHIR
INTRODUCTION
A number of developing countries exports a variety of seafoods including frozen shrimps, frozen lobster tails and dried fish. Because of their common aquatic origin, frog legs are also categorized along with seafoods. Drastic changes take place in the nature of the export trade in marine products of the total exports, frozen shrimps constitute the major part. This clearly points to the dynamic growth of the freezing sectors of the fish industry in some developing countries.
Despite the progress in the fishery trade for the export market, utilization of seafoods for local consumption is far from satisfactory. The fishery industry is mainly located on the coast. For that reason the transportation of fish in a fresh form poses serious problems for inland distribution. Frozen sea-foods require the maintenance of freezing unite from the processing plant to the retailer's market; such facilities are as yet inadequate in most of the developing countries. Due to indifferent methods of handling and processing, besides prevailing unhygienic practices, fish and fishery products transported in ice often do not reach their destination in an acceptable quality. During a period of glut, considerable quantities become spoiled from a lack of adequate processing and storage facilities. Moreover contamination with pathogenic microorganisms is also favoured under these conditions.
This lecture will deal with the comparative efficacy of processing technologies to ensure shelf-life and hygienic quality of shrimps and frog legs.
1. SHRIMPS
1.1 Good manufacturing practice (GMP) for shrimps
Table 1. Good manufacturing practice for shrimps
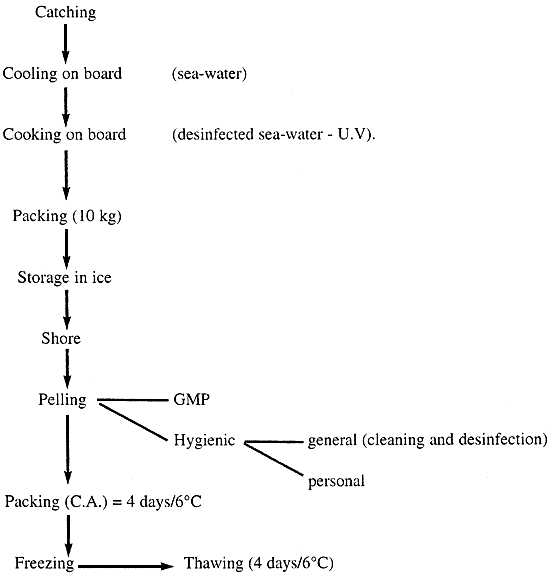
These shrimps are very expensive and show a short shelf-life. There exist still a risk of contamination with pathogenic bacteria due to the manual peeling.
Bacteriological quality :
| - Total plate count (mesophilic) | < 105/g |
| - Total plate count (psychrotrophic) | < 105/g |
| - Enterobacteriaceae | < 100/g |
| - Congulase positive staphylococci | < 50/g |
1.2. Actual situation for Crangon crangon
Table 2. Processing of Crangon crangon
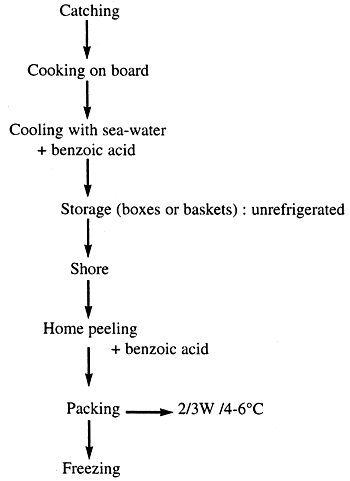
Theses shrimps are expensive and have an acceptable shelf-life. Nevertheless there exist a high risk of contamination with pathogenic bacteria due to the home peeling.
Bacteriological quality :
| - Total plate count (psychrotrophic) | 107/g |
| - Enterobacteriaceae | 103/g |
| - Congulase positive staphylococci | 103/g |
1.3. Catching and processing procedures in developing countries
Shrimps are usually caught by trawlers. It is normal practice in commercial fisheries to wash shrimps with clean sea-water to eliminate contaminating mud that can carry many bacteria. In some fisheries, larger shrimps are “headed” on board the vessel. This procedure elmiminates the head, gills and thorax containing organs and some of the viscera, thereby removing a large internal source of bacterial contamination but exposing flesh at the broken surface. Bacteriologically there seems to be little benefit in this technique, but it does eliminate most of the enzymes responsible for development of black spot (melanosis). Shrimps are normally iced to preserve their quality on board the ship, during transport on shore and also during storage prior to processing. This inhibits growth of mesophilic bacteria. Shrimps can undergo different treatments according to their destination.
1.3.1. Raw shrimps
At the processing plants they are washed and block-frozen. Sometimes they are peeled or only headed before freezing.
1.3.2. Cooked and peeled shrimps (C/P)
The shrimps are blanched (100°C/4'), peeled and block-frozen. Steaming for 4 minutes (blanching) effectively eliminates the formation of black spots by enzyme inactivation.
1.3.3. Cooked, peeled and cooked shrimps (C/P/C)
The shrimps are blanched, peeled and cooked again and then block-frozen of individually quick frozen (IQF) with glazing.
1.4. Processing in importing countries
Frozen shrimps (raw, CP and CPC) are imported by the United State of America, Australia, Japan and European Countries and further processed. This is summarized in table 3.
Table 3. Processing of frozen shrimps imported from developing countries
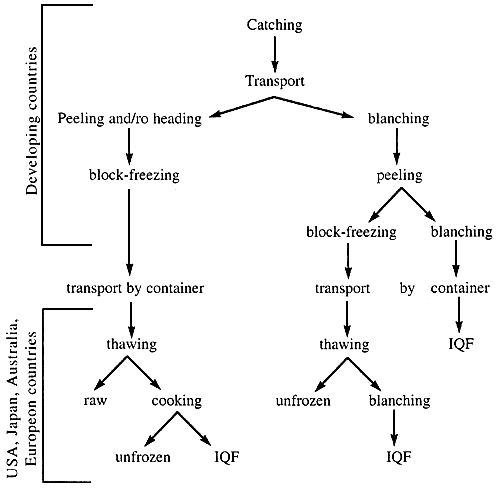
1.5 Microbiology of shrimps
1.5.1. Saprophytes and spoilage
Most shrimps have a very high bacterial count at the time of receipt ashore. The qualitative and quantitative composition of the bacterial flora of raw shrimps depend on the waters from which they come, the season, the species and the handling on board and on shore. Tropical shrimps show micrococci, coryneforms and gram-negative rods as the principal components of the micro-flora. During the storage of shrimps in ice, psychrotrophic gram-negative bacteria become dominant, and these may be either pseudomonas, Acinetobacter, Moraxella (Achromobacter), or a mixture of both.
Coryneform bacteria may persist at levels in excess of 10%, but micrococci are only present in small numbers. The total count of bacteria in raw shrimps can fluctuate between 105 and 107/g of tissue. By cooking the qualitative and quantitative composition of the resident population of bacteria can be completely changed. The total number of bacteria of cooked unpeelet shrimps fluctuates between 103 106/g. This depends on the blanching process, the cooking time and the microbial quality of the cooking water. The total number of bacteria of peeled and cooked shrimps is rather low (103 – 104/g). For technological and organoleptic reasons it is impossible to peel shrimps before cooking. Shrimps are mostly cooked before peeling by hand. Consequently the total number of bacteria fluctuates between 106 and 108/g. This microflora will deteriorate the shrimp flesh seems to undergo many of the same biochemical changes as are seen in fish.
The first step of deterioration is the breakdown of trimethyl-aminoeoxide (TMAO) to trimethylamine (TMA)
CH3 CHOHCOOH + (CH3) 3NO → CH3COCOOH + (CH3) 3N + H2O
LACTIC ACID + TMAO PYRUVATE + TMA
CH3 COCOOH + (CH3) 3NO + H2O → CH3COOH + (CH3) 3N + CO2 + H2O
TMAO is reduced to TMA by triamineoxidase producing bacteria (Pseudomonas, Acinetobacter, Enterobacteriaceae, Micrococci).
The second step is the breakdown of amino acids:
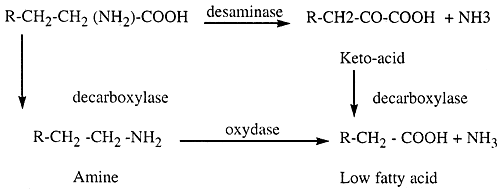
During spoilage volatile basic substances (TVN) increase and the pη rises. Discoloration results fro the oxidation of pigments and sometimes from enzyme reactions (melanosis) leading to a condition known as black spot. Shrimp enzymes, not bacteria, are responsible for this. Because of their small size and high surface to volume ratio, shrimps spoil more quickly than fish.
1.5.2. Pathogens
When they are taken in inshore waters that may be polluted, shrimps may carry adventitious pathogens from sewage or land runoff.
Vibrio parahaemolyticus represents a significant problem in the case of Crustaceae. Shrimps have been incriminated in large outbreaks of Vibrio food poisoning due to cooked shrimps that were recontaminated.
Clostridium botulinum types A and C have been isolated from shrimps in the tropics. The hasard from these organisms would seem to be negligible under normal handling and processing conditions.
Due to hand-peeling shrimps can be contaminated by Staphylococcus aureus and other pathogenic microorganisms e.g. Salmonella, Shigella, Escherichia coli. Some investigators report counts as high as 103 to 104/g.
It can be summarised that tropical shrimp (cooked and peeled) are heavily contaminated with microorganisms due to the unfavourable conditions of handling and processing. The intrinsic factors of the shrimps (pH, aw nutrient content) on the one hand and the extrinsic parameters in tropical areas (temperature, relative humidity) on the other hand are extremely favourable for microorganisms to proliferate before freezing and to reach high levels of contamination in the end product. It is known that without treatment shrimps can only be stored for a few days at low temperature due to spoilage caused by psychrotrophic microorganisms. The normal practice of increasing shelf life of cooked and peeled shrimps is the addition of preservatives, such as benzoic acid. Growing concern on environmental pollution and loading of foodstuffs with additives intensifies research on cleaner techniques of conservation. One of these techniques is gamma irradiation. Normal handling and commercialization of shrimps only needs a treatment whereby the number of microorganisms is decreased to a microbial count sufficient for extending the shelf life and to kill pathogenic microorganisms.
1.6. Irradiation of tropical shrimps
In our laboratories we studied the decontamination of shrimps handled in tropical areas.
The shrimps used in this study belong to the family of the Penaeidae. It is caught off shore malaysia and Thailand. They are cooked, sorted and hand-peeled. The cooked and peeled shrimps are deep-frozen in blocks of 5 lbs nett weight and transported by container.
The deep-frozen shrimps are gamma-irradiated using an experimental 10–60 source Gamma cell 220 (AECL), with a dose of about 0,8 KGY/hr. For this irradiation small deep-frozen blocks of 90 g, surrounded by 2 cm polystyrene to isolate the blocks, were irradiated. During the highest applied dose the temperature increased from -20°C to -3°C. All other doses had a smaller temperature increase. The deep-frozen blocks were irradiated with doses up to 5 KGY. It is found that up till 3 KGY, there is a linear relationship between the number the number of micro-organisms and the received dose, flattening out horizontally at higher doses. A does of 5 KGY is necessary to reduce the total aerobic bacteria by 3 log 10 units. In our experiments the total number of bacteria is decreased from 5.106 /g to 4.3 103/g. After irradiation with 5 KGY, the remaining radio-resistant microflora consist partly of spores (Bacillus spp.), gram-positive cocci, streptococi (micrococci), gram-positive rods (Bacillus spp.) and gram-negative rods (Moraxella). The experiments on extension of shelf life show that with a dose of 5 KGY the shelf life at 6°C is extended from 4 to 8 days.
Without detailed examination the experiments even with a dose of 5 KGY, showed no specific irradiation off-odors or color changes (Van Cleemput et al., 1980). It is known from literature that an irradiation dose of 5 KGY will kill most of the pathogenic microorganisms except spores. The normal practice of increasing shelf life time of cooked and peeled shrimps in European countries is the addition of benzoic acid (0,5 – 1,0). Therefore the combined effect of gamma irradiation and chemical preservation on the shelf life extension at 6°C of prepacked tropical cooked and peeled shrimps has been investigated (Debevere et al, 1981).
Bock-frozen shrimps were irradiated with a dose of 5 KGY, Thawed and a mixture of 3 g benzoic acid and 6 g sodium benzoate was added per kg of shrimps. The final pH of the shrimps was 5.9.
Shrimps are packed in alumiuium tray covered with a plastic sheet and stored at 6°C.
From the bacteriological results obtained it could be concluded that a) gamma irradiation of tropical cooked and peeled shrimps with 5 KGY reduces the bacterial contamination by 3 log units (the totale number of psychrotropic bacteria is reuced from 8 to6/g to 5 103/g) b) the addition of the benzoic acid-benzoate mixture reduces the initial bacterial count by I log unit in the irradiated and unirradiated shrimps c) a lag phase could be observed till the ninth day whereafter the logaritmic growth phase is started.
The level of TMA remains almost constant in the inirradiate shrimps treated with benzoic acid-benzoate. However by irradiation with 5 KGY, the level of TMA in the irradiated shrimps is increased with 2 mg N %. This level remaining also constant during storage of 6° C. Hence it could be concluded that all triamineoxidase producing microorganisms were killed by irradiation with 5 KGY.
The amount of ammonia produced in unirradiated treated shrimps is higher than amount produced in irradiated treated shrimps. According to the proposed threshold value of 25 mg N % of TVN for shrimps it could be concluded that the use of benzoic acid in irradiated shrimps permits a shelf life time at 6°C about 21 days. This is an extension of 7 days over unirradiated shrimps treated with benzoic acid, 14 days over irradiated shrimps which are not treated with benzoic acid.
Microbial reduction curves in IQF, and thawed shrimps were estalbished. To reduce the contamination in thawed shrimps a dose of 3 KGY is necessary. In IQF shrimps than 5 KGY are necessary.
2. FROGLEGS
2.1. Catching and processing procedures
Fresh frog legs means the skinless hind legs of freshly killed frogs.
Therefore only live frogs of good quality should be accepted for processing, Frogs are washed as needed to remove any contamination e.g. soil, faeces and slime. Only potable water may be used for this purpose. The live frogs are then put into a 10 % solution frequently containing more than 200 ppm of chlorine, to paralyze and anaesthetize them.
The hindlegs are then cut at the abdomen above the waist in such a manner the intestines are left intact. The legs are immediately washed to remove blood and all extraneous material. The legs are trimmed by removing bits of membrane, hanging pieces of flesh, the remaining portion of the cloaca and skinned. Sometimes more washings are carried out with chlorine solutions up to 250 ppm, in order to reduce the number of salmonellae on the surface of the skin. The legs are finally wrapped in pairs in polyethylene films or packed in polyethylene bags and frozen.
Processing of frog legs should be carried out as an operation separated entirely from other food processing operations such as for shrimps, shellfish or other fish.
2.2 Microbiology of frog legs
It is well known that reptiles and amphibia frequently harbor salmonellae and during transport from the point of cacpture to the local slaughterhouse, the level of contamination will increase. The processing procedure includes several steps to reduce the number of bacteria and to avoid cross-contamination; but even when the production of frog legs is carried out under the most hygienic conditions, elimination of all salmonellae is difficult to achieve. Escherichia coli and Staphylococcus aureus are also found in frog legs. Although frog legs are invariably cooked for consumption many lots have been rejected in both exporting and importing countries.
India and Indonesia are two important exporting countries. In our laboratories we examined 8 samples exported by Indonesian factories and 3 samples exported by Indian suppliers (table 4).
Table 4. Bacteriological quality of frog legs (Debevere, 1981).
| Origin | Total number/g | Enterobac teriaceae/g | E.coli/g | D-streptococcus/g | Staph. aureus/g | Salmonella in 25 g. |
| Indonesia | 980,000 | 1,600 | 160 | 8,500 | 230 | - |
| " | 800,000 | 35 | 15 | 6,500 | 120 | - |
| " | 760,000 | 350 | 5 | 6,000 | 250 | + |
| " | 22,000,000 | 8,500 | 425 | 185,000 | 47 | - |
| " | 12,500,000 | 4,000 | 1,600 | 170,000 | 140 | - |
| " | 1,100,000 | 80 | 10 | 800 | 22 | - |
| " | 1,000,000 | 100 | 10 | 200 | 25 | - |
| " | 1,500,000 | 170 | 10 | 100 | 26 | - |
| India | 850,000 | 200 | 10 | 6,300 | 28 | + |
| " | 820,000 | 700 | 100 | 7,000 | 40 | - |
| " | 200,000 | 110 | 10 | 1,700 | 44 | - |
Several other investigators screened frogs for the presence of salmonellae (Andrew et al., 1977) (table 5).
Table 5. Incidence of salmonellae in frog legs (Andrew et al.,1977).
| Country of origin | Number of samples | Salmonella positive | |
| Number samples | % | ||
| India | 984 | 93 | 9 |
| Japan | 192 | 0 | 0 |
| Bangladesh | 168 | 22 | 13 |
| Indonesia | 72 | 26 | 36 |
| Mexico | 72 | 7 | 10 |
Nerkar et al. (1975) screened several fresh and processed commercial samples of frog legs for the presence of salmonellae, their biochemical and serological characterisation and an assessment of their sensitivity to gamma irradiation. Based on these observations a radicidation process for the control of salmonellae in fresh and frozen frog legs has been developed.
It was observed that out of 110 samples of frog legs examined, 45 were contaminated with Salmonella spp., giving the very high incidence rate of 40%. The average count in these samples was between 102-103 per gram. The common serotypes included S. typhimurium, S. enteritidis and S. newport, the first of these being the most frequently incountered.
A radicidation dose of 3 KGY is sufficient for total elmination of the Salmonella spp. In fresh legs. For frozen frog legs the dose of irradiation necessary to eliminate the pathogen was 4 KGY. Although irradiation in the frozen condition requires a higher dose, it is to be preferred, as the organoleptic changes due to the irradiation are considerably minimised by carrying out the process in frozen condition.
In our experience irradiation of frozen frog legs with 4 to 5 KGY will be safe because these doses are needed to reduce viable numbers a millionfold for some Salmonella spp. The organoleptic quality of frozen frog legs are unchanged by that treatment.
In general, the organoleptic quality decreases with storage, but there is more rapid deterioration of quality with unirradiated than with irradiated frog legs. According to Nerkar et al., (1975) unirradiated samples appear to be preferable to the irradiated ones up to 4 weeks of storage, the reverse being true beyond 12 weeks post-irradiation storage.
CONCLUSION
In practice an irradiation dose of 5 KGY can be applied for radurization and radicidation of fresh and frozen tropical shrimps and frog legs. Hence the shelf life of the fresh and/or thawed product will be prolonged and the products will be safe for public health. Moreover a treatment with 5 KGY will not change the organoleptic quality of these products. A dose of 0,1 to 0,3 KGY is adequate to prevent insect damage in dried fish produced in tropical countries. The shelf-life can still be increased by combination of j-irradiation with treatment with chemical preservatives (benzoic acid and sorbic acid) and/or with controled atmosphere packing technology.
REFERENCES
ANDREW, W.H., WILSON, C.R., POELMA, P.L. and ROMERO, A. 1977. Comparison of methods for the isolation of Salmonella from imported frog legs. Appl. Microbiol. 33, 65–68, 1977.
BOISOT, M.H. and GAUZIT, M. 1966. Disinsectization of African dried and smoked fish by means of irradiation, in “Application of Food Irradiation in Developing Countries”, IAEA, Vienna, 1966.
DAGET, J. 1966. Insect infection of African dried or smoked fish and the possibility of its control by irradiation, in “Application of Food Irradiation in Developing Countries”, IAEA, Vienna, 1966.
DEBEVERS, J., VAN CLEEMPUT, O., DEBEVERE, P. and BAERT, L. 1981. Combined effect of gamma irradiation and chemical preservation on the keeping quality of tropical shrimps (Penaeus spp.). In “Psychrotropic Microorganisms in Spoilage and Pathogenicity”. Academic Press, 1981.
NERKAR, D.P., KUMTA, U.S. and SREENIVASAN, A. 1975. Proceedings of a symposium held at Indian Veterinary Research Institute Izatnagar, December 16–18, 1975.
VAN CLEEMPUT, O., DEBEVERE, J., 1980. DEBEVERE, P. and BAERT, L. Gamma irradiation of tropical shrimps, Lebensm.-Wiss. u.- Technol., 13, 322–323, 1980.
By. Istvan CSENGERY
Related Aquaculture Research in Hungary
Research in Fish Culture Institute, Szarvas
- main research subjects and facilities;
- main results;
- research related to fish product quality.
Other research institution dealing with quality control and quality analyses.
Trends in the Hungarian Fishery Production
(special regards to the human impacts)
- regulation of rivers (mid of XIXth century);
- industrialization in the XIXth century;
- world wars;
- progress in the fish culture research;
- introduction of the Chinese carps;
- recent environmental pollution;
- recent political and economy changes.
Fish Consumption in Hungary
(Traditions and New Trends, Main Impact Factors)
Changes due to variations in production.
Consumers' adherence and behavior
– rigidity of the traditions;
– earlier sole of the religion;
– sport fishing activity: recreation - food source.
Fish Processing
product Range
Machinery
Manufacturers of Fish Processing Equipments
Quality Requirements for Culture and Transportation
“Draft Code of Hygienic Practice for the Production of Aquaculture” FAO. Fish Utilisation and
Marketing Services, Rome-ITALY
1. RELATED AQUACULTURE RESEARCH IN HUNGARY
The fish culture Research Institute is the center of aquaculture research and development in Hungary. It was established in 1957 as an experimental fish culture station. Since 1969 the Institute coordinates the Hungarian fish meat production research and development programs. In 1975, it was upgraded to the status of a national research institute. Within the scope of R + D programs, its activity involves basic and applied research on fish breeding, on several aspects of pond fish culture, on stock enhancement and utilization in natural waters, and on integrated fish culture, technologies (e.g. duck and fish culture; rice or crop production in dried fish pond). Its activity involves research on duck breeding and culture, as well.
The fish culture Research Institute, among its several units, has research and routine laboratories for water chemistry, aquatic biology, fish genetics, fish physiology and fish diseases. These laboratories are equipped with routine and research instruments, among which as major ones, research microscopes, spectrophotometers, centrifuges, gaschromatographs and liquid scintillation counter (for radioistope tracer studies), can be enlisted. Processing of the data obtained and modelling is carried out on IBM compatible computers. For the experimental work, the institute has outdoor and indoor fish rearing facilities, such as hatchery, fish pond systems, net-cage and race-way systems, indoor fish rearing plant with recycled water, and research facilities for duck breeding. An experimental feed mill of 1 ton per hour capacity, supplied formulated feeds for fish and ducks.
Accompanied to the research facilities, the 300 hectors pilot farm of the Institute provides possibilities for testing research result and serves also as a demonstration farm. Production of the pilot farm is important in supplying Hungarian aquaculture with broodstock, seedlings, fingerlings, as well as, with rice seed, ducklings and broodstock duck. Several high-valued hybrids, varieties, and races of fish, duck, and rice are maintained in the pilot farm, and on request, delivered to various aquaculture enterprises in Hungary and in abroad.
From the staff of the Institute, 58 persons have university or highschool graduation, among which 14 have scientific degree. The scientific work is supported by an invaluable library comprising more than 11,000 books and several volumes from 170 periodicals. The Institute regularly organises domestic and international symposiums and workshop meetings. 2 lecture halls and 1 lecture room is available for these meetings, as well as, for education.
Due to the development programmes between 1974 and 1980, supported by the Hungarian government and by the Food and Agriculture Organization of the United Nations (UNDP/FAO programmes), the Institute is now an interregional centre of the FAO Aquaculture Development and Coordination Programme. The scientific research workers and the fisheries expects of the Institute take part in various training programmes. For isntance, between 1986 and 1989, postgraduate students from Algeria, Brasil, Burma, Camerun, China, Germany, India, Indonesia, Jamaica, Kenya, Leshoto, Malaysia, Nepal, Nigeria, Pakistan, Shri-Lanka, Tunisia, Turkey, United Arab Emirates, Zambia, Zimbabve, Vietnam, etc. attended 16 training courses on general fish pond management, fish culture technologies methods of artificial propagation, fish genetics, fish nutrition and feed formulation, fish health and hygieny, integrated fish culture, and on duck culture. The results of the research and development activity of the Institute can be regarded significant both on national and international base. Among the results of the 1986–1989 period, the following titles has to be mentioned:
- Hydrobiological characterization of several Hungarian water bodies, such as the rivers körös, Tisza, Danube, Szamos, and lake öreg. These data can be applied in elaboration of environmental protection mesures, in maintaining and improvement of fish populations. The data obtained can also be utilized by local fishery entreprises to increase their capture.
- Gene engineering methods has been applied to transfer growth promotion gene into common carp eggs. Although, the program has not been finished yet, even the method developments can be regarded as valuable results in this subject.
- New high-productivity carp hybrids has been produced and tested under laboratory and farm conditions. With the best hybrid, nominated as “P 31”, a 5.0 t/ha yield was achieved in intensive monoculture technology. This genetic work based upon and supported by a unique “genebank” of carp consisting of carp subspecies, varieties and races from sevral countries in Europe and Asia.
- Nutrient requirement data for Common carp and other species has been evaluted and tabulated using literature own research data. Based on these data, fish feed for intensive rearing was formulated and tested for carp fingerlings, which allows 1 kg/kg feed conversion efficiency.
- Rationalized feeding regimes has been elaborated for polyculture technology, resulting in a 20– 25% increase in the yield.
- Species interaction effects in polyculture fish pond populations has been clarified. Data suggest, that under our conditions, beneficial effects can be obtained when the stocking rate of phytophagous species (Silver carp, Bighead carp, Grass carp) is more than 250 kg/ha. The ration of species to be stocked has been optimized.
- New anesthetics/tranquilizers (Sombrevin, Ketamin) has been tested and methods for their use has been elaborated.
- Toxic effects of chemicals used for parazitic disease treatment has been determined at down to the levels of enzymes. Safe margins of the use of that chemicals have been determined.
- Human dietetic value of the fish flesh from Chinese carps has been thouroughly studied Polyenoic fatty acid contents and human dietary effects have been investigated. (Among the freshwater fishes, the chinese carps, namely, silver carp and Bighead carp, have outstanding levels of omega-3 fatty acids, being important in the prevention and therapy of human ischemic heart diseases.)
Related research :
omega-3 contents
changes during processing
deterioration of fish fats
- Intensive culture technology for acipenserid fish species (Sterlet,/Acipenser ruthenus/, Sterlet-sturgeon/Acipenser baeri/hybrids) and for clarias/African catfish/ has been elaborated.
- New varieties of ducks have been developed, along with the development of their rearing technology (hatching, feeding, housing, etc.)
- In connection to the rice production on fish pond bottom soil, new varieties (“M-225” “Köröstàj 33”; “Olimpia 72”) have been developed. (It is notable, that more than 50% of the Hungarian rice production is based upon the seed produced in the Institute.)
- Modul-system hatchery for shrimp. The container-type, modul-system fish hatchery (developed earlier) has been modified to match the needs of propagation and rearing of shrimp and prawn. The system is patented and its manufacturing has started. (One hatchery for freshwater prawn/Macrobrachium sp./has been installed in Portugal in 1989.)
All of the earlier and recent results can be applied in practical aquaculture both in Hungary and abroad. The expert of the Institute take part in several development and construction programmes. For instance, in the 1986–89 period, the experts from the Institute, took part in development programmes (with design and construction), in Brasil, Bangladesh, China, India, Greece, Laos, Leshoto, Papua New-Guinea, Pakistan, Portugal and Vietnam and such programmes are currently going on with Hungarian participation.
2. TRENDS IN HUNGARIAN FISHERY PRODUCTION
Table 1. CHANGES OF THE ANNUEL FISH PRODUCTION IN HUNGERY (1960–1991)
| YEAR | GROSS PRODUCTION (metric tons) | % (Base : 1960) |
| 1938 | 6,600 | -- |
| 1950 | 5,260 | -- |
| 1960 | 14,950 | 100 |
| 1970 | 25,940 | 147 |
| 1980 | 33,800 | 226 |
| 1988 | 38,290 | 256 |
| 1989 | 37,510 | 251 |
| 1990 | 35,950 | 240 |
| 1991 | 29,370 | 196 |
Table 2. UTILIZERS OF NATURAL WATERS IN 1989 in HUNGARY
| UTILIZERS | AREA (ha) |
| STATE FISH FARM OF LAKE BALATON | 63,262 |
| OTHER STATER FARMS | 2,270 |
| AGRIFULTURE CO-OPERATIVES | 9,015 |
| FISHERY CO-OPERATIVES | 36,327 |
| ANGLER'S ASSOCIATION | 28,898 |
| PRIVATE SECTOR | 7 |
| TOTAL | 139,779 |
Table 3. OPERTORS OF FISH PONDS IN HUNGARY IN 1989*
| OPERATORS | AREA ha | NUMBER OF FARMS |
| STATE FARMS | 15,330 | 22 |
| REGEARCHE INSTITUTIONS | 592 | 2 |
| AGRIFULTURAL INSTITUTIONS | 4,038 | 21 |
| FISHERY CO-OPERATIVES | 2,493 | 14 |
| PRIVATE FARMS | 198 | 9 |
| TOTAL | 22,651 | 68 |
* From : Muller and Csengeri, 1990
Table 4. CHANGES IN THE SPECIES COMPOSITION IN HUNGRIAN FISHERIES*
| Year | Common carp | Chinese carp | High valued carnovores | others |
| Percentage | ||||
| 1950 | 80 | 1 | - | 19 |
| 1960 | 84 | 1 | - | 15 |
| 1970 | 80 | 4 | 1 | 15 |
| 1980 | 66 | 20 | 3 | 11 |
| 1985 | 58 | 30 | 4 | 9 |
| 1989 | 66 | 20 | 5 | 9 |
* From : Muller and Csengeri, 1990
Table 5.: DECREASE OF CAPTURES ON NATURAL WATER IN FISHERY CO-OPERATIVES*
| RIVER | DANUBE | TISZA | KOROS | ||
| FISHERY COOP. | Gyor | Obuda | Baja | Szolnok | Gyoma |
| Year | Capture | (metric tons) | |||
| 1987 | 156 | 28 | 108 | 154 | 291 |
| 1988 | 138 | 29 | 92 | 131 | 273 |
| 1989 | 119 | 18 | 68 | 70 | 176 |
* from : Muller and Csengeri, 1990
FISH CONSUMPATION IN FUNGARY:
TRADITIONS AND NEW TRENDS, MAIN IMPACT FACTORS
Table 6. CHANGES OF THE FISH CONSUMPTION IN HUNGARY
| YEARS | Consumption kg/year/capita |
| 1934–48 | 0.7 |
| 1950 | 0.6 |
| 1960 | 1.5 |
| 1965 | 1.6 |
| 1978 | 2.6 |
| 1984 | 2.5 |
| 1987 | 3.5 |
| 1989 | 3.2 |
| 1991 (estimated) | 3 |
Table 7. - PRODUCTION OF EDIBLE FISH IN VARIOUS SECTORS IN 1991, HUNGARY
| SECTOR | EDIBLE FISH (TONS) | % |
| STATE FARMS | 8,420 | 2.1 |
| AGRICULTURAL CO-OPERATIVES | 2,420 | 12.2 |
| FISHERY CO-OPERATIVES | 2,780 | 13.9 |
| PRIVATE FARMS AND FISHERMEN | 860 | 4.2 |
| ANGLER'S SOCIETIES | 5,490 | 27.6 |
| TOTAL | 19,970 | 100 |
| IMPORT (Estimated) | 10,000 |
Table 8. TRADE OF FISH FOODS IN HUNGARY*
| PRODUCT | Percentage of total sales |
| Live fish | 40.8 |
| Cleaned, fresh | 9.8 |
| Fish slices | 16.5 |
| Frozen, cleaned | 7.0 |
| Frozen, prepared | 5.2 |
| Smoked | 3.4 |
| Canned | 7.0 |
| Fried | 0.3 |
| Fish oil capsules (as paramedicines): | |
| EPASEL (Standardized, sea fish oil) | |
| FISH OIL (cod liver oil)** |
* From : Muller and Csengeri 1990
** Encapsulated by the BIOGAL Pharmaceutical Works Ltd. Debrecen, Hungary
Table 9. Number of anglers and their captures in Hungary
| Year | Anglers | Captured fish (metric tons) |
| 1950 | 17,400 | 200 |
| 1960 | 27,000 | 600 |
| 1970 | 66,000 | 1,110 |
| 1980 | 238,000 | 3,950 |
| 1985 | 298,000 | 5,496 |
| 1989 | 361,000 | 6,340 |
4 FISH PROCESSING
Product range:
Live (Transport)
Iced (Ice machines)
Salted, dried
Fresh and frozen : Slices, steaks, fillet, blocks
Marinades
Smoked fish
Paste and surimi :
Blended with flours; fishburger; fish sousage, and fish chips (extruded surimi or paste)
Surimi is a semi-processed wet fish protein prepared from minced fish. The procedure starts by washing of the minced fish flesh around 5 parts of chilled water. The washing removers blood, flesh pigments, soluble enzymes and trimethylamine, (some soluble protein is also removed.) Then, the minced flesh is dewatered, and some additives, like salt, sugar, phosphates are chopped with the minced flesh.
In the next step, the microflora, competing with the lactic acid bacteria, used later, is eliminated by the blanching procedure. Blanching is a short heat treatment (cooking), at 70 to 120°C.
Then the washed, blanched, mined fish meat is inoculated with lactic acid bacterium culture (single or in combinations), and fermented, until the pH of the mixture is 4.5–5.3.
Surimi, blended with various flours, like wheat, corn and nice flour and potato starch, are used for making fish sausage, fishburger, fish chips, fish rods, etc.
Fermenting bacteria:
| Lactobacillus acidophilus | Lactobacillus helveticus |
| Lactobacillus leichmannii | Lactobacillus casei |
| Lactobacillus lactis | Lactobacillus jugurti |
| Lactobacillus fermentium | Lactobacillus plantarum |
| Lactobacillus delbruckeii | |
| Pediococcus acidilactici | Pediococcus cerevisiae |
| Leuconostoc mesenteroides | |
| Streptoccus lactis | Streptococcus cremoris |
| Streptococcus thermophillus | |
| Bacterium sacchrityrieus | |
| Amylobacters, Acetobacters, their suitable mutants, etc. | |
| Lactobacillus | |
5. QUALITY REQUIREMENTS FOR CULTURE AND TRANSPORTATION
The quality of aquaculture products is determined at 5 levels:
origin: species-evironment (water, feed, chemicals and drug used at culture)
handling: capture, transportation, storage
processing: cleaning, treatment (physical, chemical, biological) diceing, packing, storage
retail: transport and storage, merchandizing
catering: food preparation and serving
Here we will treat the quality control and assurance questions related to production (based on the Code of Aquaculture-being under prepration by the FAO experts) and processing.
5.1 Chemicals used at farming level
5.1.1 Veterinary Drugs
Controll of diseases with drugs should be carried out only on the basis of an accurate diagnosis by a veterinarian or a qualifieed fish disease specialist.
An accurate diagnosis is essential for proper selection of medicine. Medicines for fish are veterinary drugs. The person marking the diagnosis will often need to use the service of a diagnostic laboratory for fish diseases. Laboratory examination of fish is often essential for proper drug selection and for ensuring an adequate route for the application. The management should ensure that a member of staff is responsible for general health maintenance and liaision with specialities.
Veterinary drugs must be used in compliance with regulations of the official agency having jurisdiction.
Veterinary drugs encompass compounds for prevention and treatment of viral, bacterial, fungal and protozoan diseases as well as for modification of physiological status and responses of fish.
Industrially prepared medicated feed is considered, by some, as a veterinary drug.
regulations should require the prescription of drugs for fish treatment by a veterinarian (veterinary practitioner, veterinary surgeon) or a licensed specialist for fish diseases.
Drugs must be applied to fish with great care and in adherence to instruction given by the drug manufacturer or the specialist. A person carrying out the application of drugs must be adequately trained to understant the procedure of application and the risks.
At harvesting, veterinary drug residues in fish must not be above the maximum permissible levels set up by the official agency having jurisdiction.
Drugs applied to fish remain in their tissues for a certain time. The length of time elimination of drug residues and of drug metabolites depends upon a number of factors, such as drug properties, its application, species of fish and its physiological condition as well as water enviroment, including temperature.
Drugs must not be applied to fish during a period of time before harvesting; such time must be longer than the withdrawal period for the species and the drug in question.
Drugs must be stored separately in a marked dry, dark, cold and ventilated space which should be locked and protected protected from unauthorized access as well as from insects, rodent and other vermin. Medicated feed should be clearly separated from other feed, specifically marced and adequately stored.
Records must be kept about purchase and abut all use of drugs in each of the rearing units.
5.1.2 Pesticides
Pesticides must be used in compliance with regulation of official agencies having jurisdiction.
Certain groups of pesticides, such as herbicides, algicides, insecticides, limacides and piscicides can be useful in aquaculture. Establishments should apply only those compounds which are registered for use in aquaculture and/or the aquatic enviroment by the official agency having jurisdiction.
Application of pesticides to rearing areas and their surroundings must be done with great care and with adherence to the instrucctions given by the manufacturer or the specialist. Persons carrying out the application of pesticides must be adequately trained to understand the application procedure and the risks.
Herbicides for land vegetation control on establishments must be safe for fish and for the rearing environment.
Withdrawal times and tolerances for pesticides must be respected in order to prevent residues in fish for human consumption.
Record must be kept of purchases and the use of pesticides in each rearing unit and of the land area of the establishments.
5.1.3 Other chemicals
Chemicals or herbicides useful in the treatment of fish or in the rearing environment which do not belong to categories mentioned under 5.3, 5.6 and 5.7 should be used only if safe for the hygienic quality of fish and for the rearing and surrounding environment.
5.2 Hygienic significance of fish diseases
None of the casual agents of viral, mycotic and parasitic diseases of fish have been shown to be pathogenic to man.
Although not harmful to man the presence of disease makes the fish aesthetically unacceptable.
Some bacteria causing diseases in fish can be regarded as pathogenic to man but a lack of sufficient epidemiological evidence of their implication in cases or outbreaks of human diseases still exits.
A part of the normal microflora on external sufaces and in guts of healthy fish belongs to bacterial species which may be potentially pathogenic to man. They are normally controlled by hygienic gutting and handing of fish.
5.3 Preparation for harvesting
If veterinary drugs have been used, or if there are other indications fish should be sampled before harvesting and examined for contaminants and other parameters of importance for hygienic quality.
The procedure for determining the necessity and method of sampling should be stipulated by the official agency having jurisdiction. Decisions about sampling and laboratory tests should be based upon the history of treatment with veterinary drugs, application of pesticides and/or water quality on establishments and in units to he fished-out.
The interval between sampling and harvesting should be sufficient for the timely availability of data from laboratory analysis. The results off analysis should be the basis for the decision whether to proceed with or postpone the preparations for harvesting;
Fish of temporarily objectionable hygienic quality should either remain in the same unit for a specified time interval or be transferred for purification to another unit or location.
Such situations will usually not develop; properly informed managers will respect withdrawal times for veterinary drugs and secure safe use of pesticides and other chemicals.
Fish hygienically fit for harvesting should be starved or treated adequately for emptying their guts.
Fish with empty guts better withstand the handling involved in harvesting. Hygienne in transport is also better with such 12 fish : water quality in live transport will be superior; killed fish will also remain clean in boxes or other utensils for transport.
The time for gut emptying should be adjusted to the species, temperature and characteristics of the rearing unit.
In some species, sham-netting a day or several days before netting scares fish and leads to gut emptying. In others, up to 7 to 10 days of fasting is advisable.
Units to be harvested should be prepared, if applicable, by partial or complete draining or other measures for a fast operation.
5.4 Harvesting and loading
The quantity of fish to be taken out harvesting should be planned in advance.
When complete harvesting of a unit is undertaken, adequate transportation capacity should be available or continuously arriving for the whole catch.
Harvesting techniques should be adjusted to the species, sizes, methods of cultivation, characteristics of the rearing unit and climatic condition.
There may also be national regulations that must be complied with.
The sequence of procedures during harvesting should be adjusted to the type of fish transportation
Depending upon product and other specifications, fish will be transported from the harvested unit alive or freshly dead.
In hot climates or weather, harvesting should be preferably carried out during the morning hours when water and air temperatures are lowest and exposure to the drying effect of the sun is minimal.
The whole process of harvesting and loading should be efficient and careful to preserve the hygienic
quality of fish
Harvesting should be carried out with minimum of stress, fatigue and physical damage to fish
Techniques and procedures of harvesting should prevent excessive stress, intensive or prolonged muscular exercise as well as internal and external physical injuries. The size, layout and construction of units, the equipment and organisation of operations should be harmonized.
In temperate climates, harvesting of large ponds should be predominantly carried out at periods of low water temperatures. In hot climates or weather, such ponds should be partially harvested or havested by multiple seining while full witch water and, if necessary, harvested completely at Techniques and procedures of harvesting should efficiently concentrate the desired such ponds should be partially harvested or harvested by multiple seining while full with water and, if necessary, harvested completely at reduced water levels and complete draining.
Techniques and procedures of harvesting should efficiently concentrate the desired quantity of fish at the desired time.
Where of feed cannot be effectively withdrawn, the harvesting technique should include a step for purging the digestive track of the fish.
The process of concentrating and landing should cause a minimum of stirring up of matter from the bottom of the unit.
Utensils for netting or otherwise concentrating the fish should be of such properties and quality that physical damage is avoided or minimal.
Fish concentrated for landing and kept concentrated for any extended period should be provided with enough oxygen and water circulation.
Mechanical aeration of water or adequate circulation or enough space and water exhange with the surrounding should provide hygienic conditions to the densely concentrated fish.
Fish should not be trampled or stood upon when concentrated in net or other devices and should not be piled up deeply onto sorting devices or into containers without water.
Landing of fish should be preferably carried out by mechanical devises adjusted to the species, size and other conditions, in order to minimize adverse effects of manipulation upon quality.
5.5 Sorting and Grading
Sorting and grading should be integrated into the whole operation in such a manner as to secure continuous flow of fish from harvested unit to the transporting devise or devises.
Fish which have died before harvest or show external signs of disease or physical damage thus rendering them unfit for human consumption should be segregated as soon as possible prior to or during sorting ans grading, and kept separate.
Fast removal of unacceptable fish is essential for the overall hygiene of operation and for the hygienic quality of fish. Culled unfit fish, other animals and substances should be utilized or disposed of by means acceptable to the official agency having jurisdiction.
Any foreign or undesirable animals, plants, mud or other material should be removed during sorting and/or grading.
The sorting should be carried out, where applicable, by mechanical devices in order to speed up the process and improve its quality.
In an establishment with adequate facilities, sorting and grading of live fish can be conveniently carried out at a centralized location.
Catches from polyculture technologies should be stored rapidly in other to avoid damage due to abrasion, particularly where compostition of species includes spiny or rough skinned species.
5.6 Handling and Packaging of fresh fish
Fish destined for transportation if fresh form should be quickly sorted, if applicable, chilled and killed.
Rapid cooling after harvesting should ensure maintenance of good hygienic quality and prolong shelf life. For rapid cooling fish should be introduced into a tank with adequately chilled water. For many species, chilling will aslo be a convenient method of killing.
Killing should be performed humanely and quickly
Fish should be killed by acceptable methods which might include spiking or by transfer to sufficiently
cold seawater or clean water, or by tranquilizing them by carbon dioxide bubbled into water
filled containers.
Bleeding of large fish, if applicable, should be carried out in contrainers.
The quality of bled fish is more consistent. However, they must also be chilled rapidly.
Packaging containers should be clean and come from a hygienic storage area. Packaging should be carried out under conditions which prevent contamination of the product.
Packaging containers should not transfer to the fish any objectionable or harmful substances, odours or flavours, and should protect fish against damage, deterioration or contamination.
Fresh cooled fish should be stowed in boxes. Bulk shelf stowage is not recommended, unless used for short term transportation.
Fish should be stowed in boxes according to species and sizes in an orderly manner and properly iced, with fine crushed ice; boxes should not be overfilled.
Adequate quantities of finely divided ice should be used in packing fish transport. The ice should be will dispersed amongst the fish and should also surround it in sufficient amounts to keep it out of contact with the container surfaces during the journey.
The amount of ice required when packing will depend on the length of journey and the ambient temperatures involved. The ice should always be more than enough to last the journey; the quantity will depend on the ambient temperature and available insulation. If the ice is well mixed through the load and surrounding it, then deterioration of fish quality due to rise of temperature and the resulting growth of micro-organisms will be minimized.
5.7 Hygiene Controle Programme
It is desirable that each aquaculture establishment in its own interest designates a single individual whose duties are preferably divorced from production to be held responsible for the cleanliness and hygiene of the establishment.
Such a person or his staff should be a permanent part of the organization or employed by the organization and should be well trained in the use of special cleaning tools, in applying cleaning and disinfection procedures, and in the significance of contamination and the hazards involved. A permanent cleaning and disinfection schedule should be drawn up to ensure that all parts of establishment as well as equipment and utensils are kept out of contamination.
5.8 Live fish transportation
Harvested live fish can be transported within the establishment for storage, conditions or purification or directly to the market.
Any chemicals, drugs or anaesthetics used should be acceptable to the national agency having jurisdictions.
Transportation of liver fish should be carried out in containers of adequate design and construction for the foreseen load and transport conditions.
Supporting equipment should secure desirable oxygen concentration in water. For long distance transportation it may be necessary to carry emergency devices for oxygenation.
For transport to distant markets, live fish from pond culture systems should be flushed out and conditioned by storing for a sufficient time to empty their guts completely and to recover from netting and harvesting stress. Such conditioning can be carried out in special units with a constant water flow or within the unit being harvested.
The water temperature in the transportation containers should be reduced adequately as to prevent stress by sudden temperature drop and yet to secure reduction of the metabolicrate in fish.
The difference between temperature in the harvested unit and in the transportation container should not be greater than tolerated by the species. Stress or mortality in transportation caused by temperature shock, can cause water quality deterioration and impair the hygienic quality of fish.
The ratio (by volume) between the water and the fish should be predetermined before loading to ensure its suitability for the species, water temperature, length of transportation the foreseen frequency of water exchange on route.